
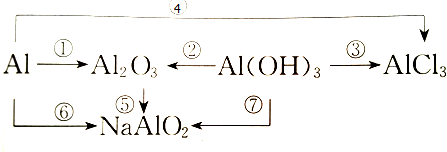
| ||
| ||
| ||
| ||


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| A、2Fe3++2I-═2Fe2++I2 |
| B、Cl2+2Br-═2Cl-+Br2 |
| C、I2+2Cl-═2I-+Cl2 |
| D、2Fe2++Br2═2Fe3++2Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,平衡将正向移动 | ||
B、X的正反应速率是Y的逆反应速率的
| ||
| C、降低温度,混合气体的平均相对分子质量变小 | ||
| D、增加X的物质的量,Y的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、2:1 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、196kJ |
| B、98kJ |
| C、<196kJ |
| D、>196kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4在医学上用作钡餐,Ba2+对人体无毒 |
| B、煤的干馏和石油的分馏均属化学变化 |
| C、用食醋可除去热水壶内壁的水垢 |
| D、明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com