
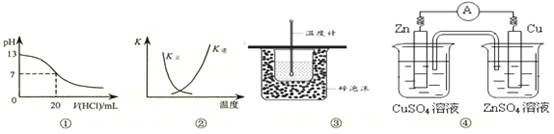
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| C.图③装置用于测定中和热 |
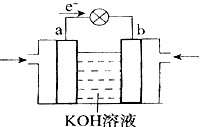
| D.图④装置可以构成锌、铜、硫酸铜溶液原电池 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
 H2+I2(g)
H2+I2(g) 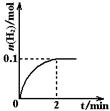
 H++OH-)平衡 移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的 。
H++OH-)平衡 移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应 CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应 |
| B.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除 |
| C.室温下,将浓度为0.1mol.L?1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变 |
| D.电解精练铜时,阳极泥中常含有金属金、银、锌等。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.升高温度 | B.加入催化剂 | C.将XQ3及时分离出去 | D.增大反应体系的压强 |
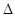 H=-393.5kJ/mol
H=-393.5kJ/mol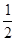 Y2(g)=WY2(g);
Y2(g)=WY2(g);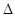 H=-238.0kJ/mol。则 24g W与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为 。
H=-238.0kJ/mol。则 24g W与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
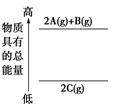
| A.①③⑥ | B.②④⑤ |
| C.①③④ | D.③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是| A.①② | B.④ | C.③ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
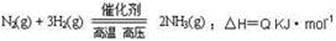
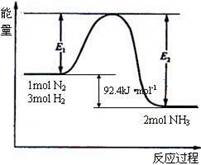
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgNO3 | B.NaNO3 | C.Mg(NO3)2 | D.Al(NO3)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com