
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
| △c |
| △t |
| 0.2mol/L×0.003L |
| 0.003L+0.002L+0.002L+0.003L |
| 0.06mol/L |
| 4min |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
| A、32gO2和O3的混合气体中含有的氧原子数为2NA |
| B、标况下,11.2L乙醇中所含的碳原子数目为NA |
| C、1 L 0.1 mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2 NA |
| D、过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、75%的B溶液常用以医疗消毒 |
| B、D、E都能与NaOH溶液反应 |
| C、B、D、E三种物质可以用饱和Na2CO3溶液鉴别 |
| D、由B、D制备E常用浓H2SO4作脱水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
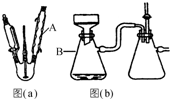 对叔丁基杯芳烃的合成原理如下,装置如图:
对叔丁基杯芳烃的合成原理如下,装置如图: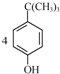 +4HCIHO
+4HCIHO| Naoh,二苯醚 |
| 4h |
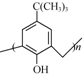 +4H2O
+4H2O查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | I-的初始浓度 (mol?L-1) | OCl-的初始浓度 (mol?L-1) | OH-的初始浓度 (mol?L-1) | 初始速率v (mol?L-1?s-1) |
| 1 | 2×10-3 | 1.5×10-3 | 1.00 | 1.8×10-4 |
| 2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
| 3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
| 4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 物 质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3可与水反应生成Al(OH)3 |
| B、铝是人类使用最早的金属之一 |
| C、Al2O3是碱性氧化物 |
| D、Al(OH)3沉淀可以溶于盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com