
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一.
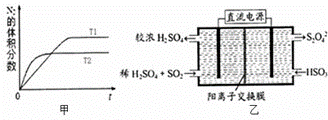
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图甲所示,根据图象判断反应N2(g)+O2(g)═2NO(g)的△H 0(填“>”或“<”).
②在T3温度下,向2L密闭容器中充入10mol N2与5mol O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)= .该温度下,若开始时向上述容器中充入N2与O2均为1mol,则达到平衡后N2的转化率为 .
(2)利用如图乙所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2.
①阳极的电极反应式为 .
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32﹣生成.该反应中氧化剂与还原剂的物质的量之比为 .
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol•L﹣1的醋酸与b mol•L﹣1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)═c(CH3COO﹣),则该混合溶液中醋酸的电离常数Ka= (用含a和b的代数式表示).
(4)引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,任写一种与SO42﹣互为等电子体的分子 .
考点: 反应热和焓变;常见化学电源的种类及其工作原理;产物的百分含量随浓度、时间的变化曲线;化学平衡的计算.
专题: 基本概念与基本理论.
分析: (1)①根据“先拐先平数值大”原则判断的T1、T2大小,再根据平衡时氮气的体积分数判断温度对平衡的影响;
②v= ,再据速率之比等于化学计量数之比求算;利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量,再求出平衡浓度,代入平衡常数表达式计算;
,再据速率之比等于化学计量数之比求算;利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量,再求出平衡浓度,代入平衡常数表达式计算;
令N2转化的物质的量为xmol,利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量,再求出平衡浓度,代入平衡常数列方程,求出x值,再根据转化率定义计算;
(2)①依据电极原理和反应过程中的离子变化写出电极反应;
②依据在碱性条件下,阴极排出的溶液为S2O42﹣,二氧化氮与其发生反应4S2O42﹣+2NO2+8OH﹣═8SO42﹣+N2+4H2O,依据方程式即可解答;
(3)溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合概念计算;
(4)等电子体,即微粒中所含电子数相等.
解答: 解:(1)①根据图象判断,T2曲线先到达平衡,反应速率大,温度较高,而温度升高,氮气的体积分数减小,说明升高温度平衡向正反应移动,升高温度向吸热方向进行,故正反应为吸热反应,△H>0.
故答案为:>;
②v(NO)= =
=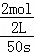 =0.02 mol•L﹣1•s﹣1,v(N2):v(NO)=1:2,所以v(N2)=0.01mol•L﹣1•s﹣1;
=0.02 mol•L﹣1•s﹣1,v(N2):v(NO)=1:2,所以v(N2)=0.01mol•L﹣1•s﹣1;
利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量.
N2(g)+O2(g)⇌2NO(g),
起始(mol):10 5 0
反应(mol):1 1 2
平衡(mol):9 4 2
所以平衡常数k=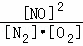 =
=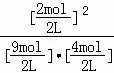 =
= ;
;
令N2转化的物质的量为xmol,则
N2(g)+O2(g)⇌2NO(g),
起始(mol):1 1 0
反应(mol):x x 2x
平衡(mol):1﹣x 1﹣x 2x
所以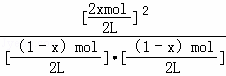 =
= ,解得x=
,解得x=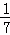 ,
,
N2的转化率为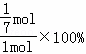 ×100%=14.3%.
×100%=14.3%.
故答案为:0.01mol•L﹣1•s﹣1;14.3%;
(2)①依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2﹣2e﹣+2H2O═SO42﹣+4H+;
故答案为:SO2+2H2O﹣2e﹣=SO32﹣+4H+;
②阴极排出的溶液为S2O42﹣,二氧化氮与其发生反应,S2O42﹣中硫元素由+3价,变为硫酸根中硫元素为+4价,S2O42﹣被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为4S2O42﹣+2NO2+8OH﹣═8SO42﹣+N2+4H2O,所以该反应中氧化剂与还原剂的物质的量之比为1:2,
故答案为:1:2;
(3)反应平衡时,2c(Ba2+)=c(CH3COO﹣)=bmol/L,据电荷守恒,溶液中c(H+)=c(OH﹣)=10﹣7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K= =
=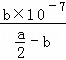 =
=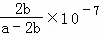 ;
;
用含a和b的代数式表示该混合溶液中醋酸的电离常数为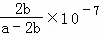 L/mol,
L/mol,
故答案为: ×10﹣7L/mol;
×10﹣7L/mol;
(4)等电子体,即微粒中所含电子数相等,1molSO42﹣中含48mol电子,含48mol电子的分子有CCl4 或 CF4 等,故答案为:CCl4 或 CF4.
点评: 本题考查热化学方程式,化学平衡常数、化学平衡影响因素分析,原电池原理的分析应用,主要是弱电解质电离平衡常数的计算,题目难度中等.


科目:高中化学 来源: 题型:
下列操作不能达到实验目的是( )
|
| A. | 在蛋白质溶液中加饱和(NH4)2SO4溶液,蛋白质不能析出 |
|
| B. | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸 |
|
| C. | 石蜡和碎瓷片(催化剂)混合加热,生成的气体能使酸性高锰酸钾溶液褪色,能初步判断生成的气体中含有不饱和烃 |
|
| D. | 淀粉溶液中加入硫酸加热水解,冷却后,直接加银氨溶液做银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:P4(s、白磷)+5O2(g)═P4O10(s);△H=﹣2983.2kJ/mol4P(s、红磷)+5O2(g)═P4O10(s);△H=﹣2954kJ/mol
那么,1mol红磷转变成相应物质的量白磷时,应是()
A. 吸收29.2kJ热量 B. 放出29.2kJ热量
C. 放出7.3kJ热量 D. 吸收7.3kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
请回答下列问题:
(1)电极X的材料是;电解质溶液Y是;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为,;
(3)外电路中的电子是从 电极流向 电极.

查看答案和解析>>
科目:高中化学 来源: 题型:
与图中相对应的叙述是()
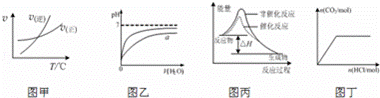
A. 由图甲表示的反应速率随温度变化的关系可知该反应的△H>0
B. 图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C. 图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D. 图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示物质结构的化学用语或模型图正确的是 ( )
A.H2O2的电子式:H+[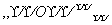
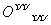
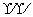 ]2-H+ B.CS2的比例模型:
]2-H+ B.CS2的比例模型:
C.14C的原子结构示意图: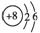 D.CCl4的结构式:
D.CCl4的结构式: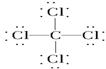
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断中一定正确的是 ( )
A.若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y的强
B.若R2-和M+的电子层结构相同,则原子序数:R>M
C.若X、Y都是气态氢化物,且相对分子质量:X>Y,则沸点:X>Y
D.若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列物质:①丁烷②2﹣甲基丙烷③戊烷④2﹣甲基丁烷⑤2,2﹣二甲基丙烷,其沸点排列顺序正确的是( )
A.①>②>③>④>⑤ B.⑤>④>③>②>① C.③>④>⑤>①>② D.②>①>⑤>④>③
查看答案和解析>>
科目:高中化学 来源: 题型:
浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)═CaCl2+Cl2↑+2H2O.用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是()
①CO2 ②HCl ③H2O(气) ④O2.
A. ①②③④ B. ②③④ C. ②③ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com