
【题目】银锌电池工作示意图如下,原理为Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法错误的是
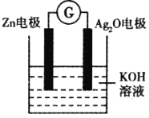
A.Zn电极是负极
B.Ag2O电极发生还原反应
C.该装置可实现电能转化为化学能
D.电子由Zn电极经导线流向Ag2O电极
科目:高中化学 来源: 题型:
【题目】铝是一种很重要的金属,可以发生一系列反应制备物质,如图所示。下列说法错误的是
( )

A.反应①又称铝热反应,可用于野外焊接铁轨
B.反应②③都有氢气生成,产生等量的氢气时转移的电子数相等
C.工业上用反应⑦制备铝时,常加入冰晶石以降低氧化铝的熔融温度
D.常用反应⑥制备Al(OH)3,方法是向Al2(SO4)3溶液中滴加足量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由SO2和O2制备SO3(熔点16.8℃,沸点44.8℃)的模拟装置如下图所示)(加热和夹持装置省略):

下列说法正确的是
A. 装置①中的试剂为饱和NaHSO3溶液
B. 实验室可用铜与稀硫酸在加热条件下制取SO2
C. 裝置③反应管中的铂石棉用作反应的催化剂
D. 从装置⑤逸出的气体有过量的SO2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
![]()
A. 氢化物的稳定性:R<Q<T
B. T的单质是一种良好的半导体材料
C. Q、R的简单氢化物分子所含质子数、电子数与氖原子相同
D. T、W的最高价氧化物的水化物的酸性W强于T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年,三鹿等多家乳制品企业为使蛋白质含量检测合格而加入三聚氰胺,使多名儿童患肾结石,实验室可用下列实验装置测定三聚氰胺的分子式。

已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成二氧化碳、水、氮气,实验测得装置B增重0.54g,C增重1.32g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是_____。
(2)需要加热的装置是____(填字母代号)。
(3)装置D的作用是_____。
(4)F处读数时应该注意的是____、_____。
(5)三聚氰胺的分子式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究H2O2分解的速率及影响因素,在相同温度下按照下表所示的方案完成实验。

(1)上述实验方案中,探究的变量因素只有催化剂的实验组合是_____和_____。
(2)实验④过程中氧气的生成速率和时间的趋势关系如图所示,判断该反应是反应(填“放热”或“吸热”)______。
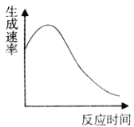
(3)实验⑤:在试管中加入10mL 0.4mol/L H2O2溶液,加入固体催化剂,在一定温度下测得不同时刻生成O2的体积(以折算为标准状况)如下表所示(假设反应过程溶液的体积保持不变):
![]()
①反应6min,H2O2分解了_______%。
②0至6min,以H2O2的浓度变化表示的反应速率为υ(H2O2)=________molL-1min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是____________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱:____________>____________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:________________________。
(4)写出e的单质在空气中燃烧所得产物的电子式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
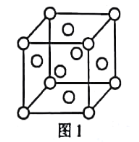
【题目】已知元素周期表中前四周期的元素a、b、C、d、e、f的原子序数依次增大。a、c的基态原子中均有2个未成对电子,c与d位于同一主族,元素e的基态原子的3d轨道上有2个电子,基态f原子M层有2个未成对电子且位于第Ⅷ族。
(1)元素e在周期表中的位置为___;f的单质的晶胞结构如图1所示,该晶胞为___堆积。
(2)c元素可分别与a、b元素组成多种简单阴离子,其中中心原子采用sp2杂化,空间构型为平面三角形的离子有___(填离子符号)。一个氢原子与一个a原子、一个b原子组成的分子中σ键和π键的数目之比为___。
(3)基态原子未成对电子数与b相同的前四周期元素中,除了与b同主族的元素外,还有___(填元素符号)。
(4)分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),d元素的低价酸性氧化物其大π键应表示___。
),d元素的低价酸性氧化物其大π键应表示___。
(5)c、f元素形成的一种晶体的晶胞结构如图2所示,其单原子层堆积结构实际如图3所示。
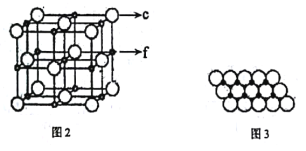
该①晶体的化学式是___。
②如图3中,c离子之间最短核间距为apm,NA表示阿伏加德罗常数的值。则该晶体中1m2单原子层的质量为___(用含a和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某此气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置),用此装置和相关试剂不能制取的气体是( )
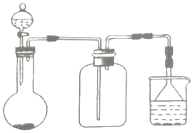
A.NH3B.SO2C.NO2D.Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com