
【题目】化学工程师为了变废为宝,从某工业废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为化工原料FeCl3晶体,主要流程如下:
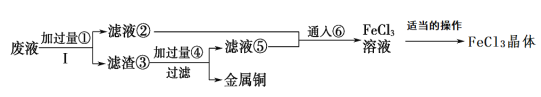
(1)步骤Ⅰ的操作名称:__________;
(2)检验滤液中②是否含有Fe3+所需试剂化学式:_____________,
(3)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:________。
(4)滤渣③加入过量的④发生的离子方程式____________,
(5)通入⑥的目的:_______________。
【答案】过滤 KSCN溶液或硫氰化钾溶液 溶液从白色沉淀很快成灰绿色,最终变成红褐色 Fe+2H+=Fe2+ +H2↑ 将溶液中的Fe2+完全转化成Fe3+
【解析】
从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用,则废液中加过量③(Fe粉),滤液为FeCl2,滤渣为Fe和Cu,滤渣中加过量④(盐酸),因Cu与盐酸不反应,则滤液⑤为FeCl2,将滤液②和⑤中通入⑥(氯气),可反应得到FeCl3溶液。
(1)步骤Ⅰ为分离氯化亚铁溶液和固体铁、铜,操作名称为过滤,本题答案为:过滤;
(2)检验滤液中②是否含有Fe3+所需试剂为硫氰化钾,硫氰化钾遇Fe3+变红,化学式为KSCN,本题答案为:KSCN溶液或硫氰化钾溶液;
(3)②为氯化亚铁溶液,加入NaOH溶液会生成白色絮状沉淀,白色沉淀迅速转化为灰绿色,最终变为红褐色,故答案为:溶液从白色沉淀很快成灰绿色,最终变成红褐色;
(4)滤渣③含有铁和铜,加入过量的盐酸,铜与盐酸不反应,只有铁与硫酸反应,生成硫酸亚铁和氢气,离子方程式为Fe+2H+=Fe2+ +H2↑,本题答案为Fe+2H+=Fe2+ +H2↑;
(5)滤液②和⑤中的溶质为氯化亚铁,通入氯气,可将氯化亚铁氧化成FeCl3溶液,本答案为:将溶液中的Fe2+完全转化成Fe3+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】H2S是一种大气污染物。干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。下列说法不正确的是( )
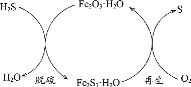
A.单质硫为淡黄色固体
B.脱硫反应为3H2S+Fe2O3·H2O=Fe2S3·H2O+3H2O
C.再生过程中,硫元素被还原
D.脱硫过程中,增大反应物的接触面积可提高脱硫效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
B.氯化铝溶液与过量的氢氧化钠溶液反应:Al3++3OH-=Al(OH)3↓
C.氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
D.碳酸氢钠溶液与稀盐酸反应:2H++CO32-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属元素Fe、Ni、Pt均为周期表中同族元素,该族元素的化合物在研究和生产中有许多重要用途。
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe在元素周期表中的位置为________________________。
②Fe的一种晶胞结构如图所示,测得晶胞边长为 a pm,则Fe原子半径为__________。
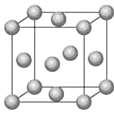
③已知:FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的空间构型为________。
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体是_________;该配合物有两种不同的颜色,其中橙黄色比较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如下图所示的结构示意图中呈亮黄色的是_____(填“A”或“B”),理由是___________。
A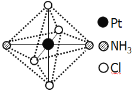 B
B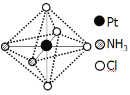
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图。
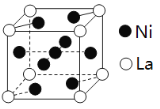
①测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为____________ (不必计算结果) 。
②储氢原理为:镧镍合金吸附H2,H2解离为原子,H原子储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心,则形成的储氢化合物的化学式为____________。
(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用![]() 表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为![]() 。 下列微粒中存在“离域Π键”的是__________。
。 下列微粒中存在“离域Π键”的是__________。
a.O3 b.SO42- c.H2S d.NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
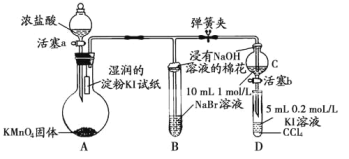
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是_____。
(2)验证氯气的氧化性强于碘的实验现象是____。
(3)B中溶液发生反应的离子方程式是______。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_____。
(5)过程Ⅲ实验的目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
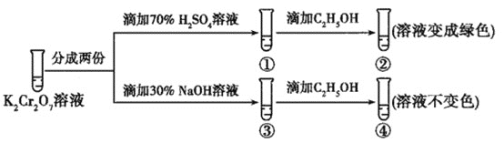
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实对应的离子方程式正确的是
A. 用石墨电极电解饱和食盐水:Cl- + 2H2O ![]() Cl2↑+ H2↑+ OH-
Cl2↑+ H2↑+ OH-
B. 用醋酸除去水壶中的水垢:CaCO3 + 2H+ === Ca2+ + CO2↑+ H2O
C. (NH4)2Fe(SO4)2溶液中滴加过量Ba(OH)2溶液:Fe2+ + 2OH- + Ba2+ + SO42— === Fe(OH)2↓ + BaSO4↓
D. 用明矾做净水剂:Al3+ + 3H2O ![]() Al(OH)3 + 3H+
Al(OH)3 + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛酸(OHC-COOH )是一种重要的精细化工产品。以高硅铸铁为惰性电极材料,用恒电势电解NaBr 溶液间接氧化乙二醛(OHC-CHO)制备乙醛酸:OHC-CHO+Br2+H2O→OHC-COOH+2HBr。装置如图所示,下列说法不正确的是( )
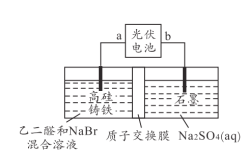
A.电极b为负极,高硅铸铁不损耗
B.阳极的电极反应式为2Br--2e-=Br2
C.光伏电池将铸铁极的电子转移到石墨极
D.电解过程中,右室溶液的pH逐渐升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com