
 .
.
| n(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
分析 (1)三氯化氮水解依据水解实质分析应生成氨气和次氯酸;
(2)热化学方程式中,反应热=反应物的总键能-生成物的总键能,据此计算出断开1mol N≡N键吸收的能量;
(3)将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据氨水的电离平衡常数的表达式计算;
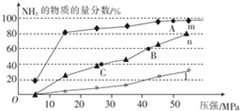
(4)①甲、乙是完全等效平衡,平衡时对应各组分的物质的量相等,根据甲中氢气的转化率计算平衡时氢气的物质的量,与乙中氢气的物质的量比较,判断反应进行方向;
②甲、乙是完全等效平衡,平衡时NH3的体积分数相等,丙相当于在甲平衡的基础上,再加入1molN2、3molH2,压强增大平衡向正反应方向移动,据此解答;
(5)①N2(g)+3H2 (g)?2NH3(g)该反应为放热反应,温度越高,氨气的含量越低;
②升高温度,平衡向逆方向移动,化学平衡常数减小;
③B点时c(NH3)=0.6mol•L-1,氨气的物质的量分数为60%,则混合气体总物质的量为$\frac{0.6mol/L}{60%}$=1mol/L,则氮气的物质的量浓度为(1-0.6)×$\frac{1}{4}$=0.1mol/L,则氢气的物质的量浓度为0.3mol/L,结合平衡常数的表达式计算.
解答 解:(1)三氯化氮水解依据水解实质分析应生成氨气和次氯酸,NCl3+3H2O═NH3+3HClO,所以最初应生成氨气和HClO,HClO的电子式为 ;
;
故答案为: ;
;
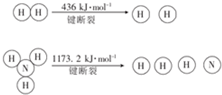
(2)已知:H-H键能为436kJ/mol,NH3中3个N-H键能为1173.2kJ/mol,设N≡N的键能为x,
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
反应热=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×1173.2kJ/mol=-92.4kJ/mol
解得:x=946 kJ/mol,则断裂1molN≡N键需要的能量为946kJ;
故答案为:946;
(3)将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=$\frac{b}{2}$mol/L,混合后反应前c(NH3•H2O)=$\frac{a}{2}$mol/L,
则反应后一水合氨的浓度为:c(NH3•H2O)=($\frac{a}{2}$-$\frac{b}{2}$)mol/L,
则氨水的电离平衡常数为K=$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{\frac{b}{2}×1{0}^{-7}}{\frac{a}{2}-\frac{b}{2}}$=$\frac{b×1{0}^{-7}}{a-b}$;
故答案为:$\frac{b×1{0}^{-7}}{a-b}$;
(4)①甲、乙是完全等效平衡,平衡时对应各组分的物质的量相等,平衡时甲容器中H2的转化率为40%,则平衡时氢气的物质的量为3mol×(1-40%)=1.8mol,乙中氢气为1.5mol,小于1.8mol,则乙容器中反应进行的方向是逆向,
故答案为:逆向;
②甲、乙是完全等效平衡,平衡时NH3的体积分数相等,丙相当于在甲平衡的基础上,再加入1molN2、3molH2,压强增大平衡向正反应方向移动,氨气的体积分数增大,故体积分数:丙>甲=乙,
故答案为:丙>甲=乙;
(5)①N2(g)+3H2 (g)?2NH3(g)该反应为放热反应,温度越高,氨气的含量越低,150℃时温度最低,所以反应进行的程度最大,即氨气的物质的量分数最大,其对应的曲线为m;
故答案为:m;
②升高温度,平衡向逆方向移动,化学平衡常数减小,B、C点在同一温度曲线上,所以B、C点的平衡常数相同,A点的温度低,所以A点的K大,则K(A)>K(B)=K(C);
故答案为:K(A)>K(B)=K(C);
③B点时c(NH3)=0.6mol•L-1,氨气的物质的量分数为60%,则混合气体总物质的量为$\frac{0.6mol/L}{60%}$=1mol/L,则氮气的物质的量浓度为(1-0.6)×$\frac{1}{4}$=0.1mol/L,则氢气的物质的量浓度为0.3mol/L,此时反应的化学平衡常数K=$\frac{0.{6}^{2}}{0.1×0.{3}^{3}}$=$\frac{400}{3}$;
故答案为:$\frac{400}{3}$.
点评 本题考查了弱电解质的电离平衡和电离常数的计算、化学平衡移动和平衡常数的计算、电子式、键能的计算等,题目难度中等,题目综合性较强,侧重于考查学生对基础知识的综合应用能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 4 v(NH3)=5 v(O2) | B. | 5 v(O2)=6 v(H2O) | C. | 5 v(NO)=4 v(O2) | D. | 3 v(H2O)=2 v(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4中含有共价键的数目为4NA | |
| B. | 常温常压下,6.4 g氧气和臭氧中含有的原子总数为0.4NA | |
| C. | 室温时,1L pH=2的NH4Cl溶液中由水电离出的H+为10-12NA | |
| D. | 一定条件下6.4gSO2与足量氧气反应生成SO3,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
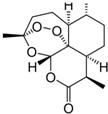 我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 青蒿素的化学式为C15H22O5 | |
| B. | 青蒿素的同分异构体可能有芳香族化合物 | |
| C. | 青蒿素可与NaOH溶液发生水解反应 | |
| D. | 青蒿素可用蒸馏水从植物提取 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
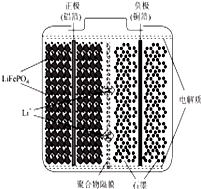 锂离子电池广泛应用与日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新呈”.
锂离子电池广泛应用与日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新呈”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
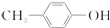 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )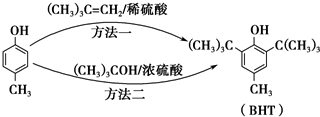
| A. | 推测BHT在水中的溶解度小于苯酚 | |
| B. | 方法一和方法二的反应类型都是加成反应 | |
| C. | BHT与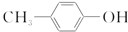 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| D. | BHT与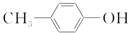 具有完全相同的官能团 具有完全相同的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第0族 | B. | 第四周期第ⅠA族 | C. | 第三周期第ⅠA族 | D. | 第三周期第ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎打翻燃着的酒精灯,立即用湿抹布盖灭 | |
| B. | 实验室制取氯气如果有尾气处理装置,可不用在通风橱中进行 | |
| C. | 给盛有液体的试管加热时,要不断移动试管或加入碎瓷片 | |
| D. | 浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上硼酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
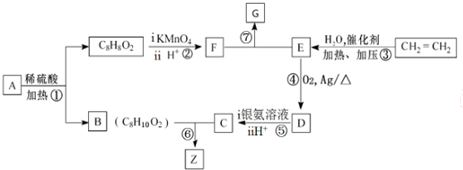
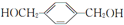 ,其所含官能团名称为羟基.
,其所含官能团名称为羟基. .
.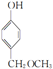 ,
,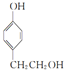 ,
,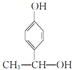 ,
,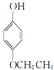 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com