
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径 (×10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
主要化合价 | 最高 正价 | +1 | +1 | +3 | +7 | +5 | - |
| 最低 负价 | -1 | - | - | -1 | -3 | -2 | |
| A. | H2Q的还原性和稳定性大于RH3 | |
| B. | Y、Z、M三种元素的最高价氧化物的水化物两两之间会反应 | |
| C. | 化合物XM,YM都是电解质,熔融状态下都能电解 | |
| D. | 元素Z、M组成的化合物熔化时破坏了离子键 |
分析 X的化合价有+1价、-1价,应为H元素,Q只有-2价,为O元素,M有+7价,为Cl元素,结合原子半径和化合价可知Y为Na元素,Z为Al元素,R为N元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:X的化合价有+1价、-1价,应为H元素,Q只有-2价,为O元素,M有+7价,为Cl元素,结合原子半径和化合价可知Y为Na元素,Z为Al元素,R为N元素,
A.非金属性O>N,元素的非金属性越强,对应的氢化物越稳定,还原性越弱,故A错误;
B.Y、Z、M三种元素分别为Na、Al、Cl,氢氧化铝为两性氢氧化物,可与氢氧化钠、高氯酸反应,故B正确;
C.HCl为共价化合物,熔融状态下不导电.故C错误;
D.元素Z、M组成的化合物为共价化合物,熔化时克服分子间作用力,故D错误.
故选B.
点评 本题考查元素位置结构和性质的关系及应用,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,题目难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4有氧化性,稀H2SO4无氧化性 | |
| B. | 由于浓H2SO4具有吸水性,故可用来与蔗糖反应做“黑面包”实验 | |
| C. | 稀H2SO4与铁、铝反应,浓H2SO4在常温下不与铁、铝反应 | |
| D. | 浓硫酸与铜片加热反应,既表现了酸性,又表现出强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
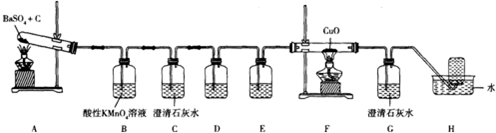
| 方案 | 操作过程及现象 |
| 甲 | 向第l支试管中滴加稀盐酸,将产生的气体通入溴水中,溴水褪色 |
| 乙 | 向第2支试管中滴加稀盐酸,将产生的气体分别通入品红溶液、CuSO4溶液中,品红溶液无变化,CuSO4溶液中产生黑色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1 mol•L-lNa2CO3溶液加水稀释后,溶液中n(H+)•n(OH-)不变 | |
| B. | NaHCO3溶液中:c(H+)+c(H2CO3)═c(CO32-)+c(OH-) | |
| C. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液中c(Na+):①>②>③ | |
| D. | pH=1的醋酸溶液与pH=13的氢氧化钠溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高压钠灯发出的黄光射程远.透雾能力强,常用于道路和广场的照明 | |
| B. | 镁合金密度小,硬度和强度大,可用于制造火箭、导弹和飞机的部件 | |
| C. | 水玻璃常用于浸泡有特殊用途的木材、纺织品等达到耐腐蚀和防火的目的 | |
| D. | 氢氧化铁胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,可用作消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
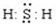
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+<Mg2+<K+<O2- | B. | Na+>Mg2+>S2->Cl- | ||
| C. | Na>Mg>Al>S | D. | Cs<Rb<K<Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖 | B. | 甘油 | C. | 氨基酸 | D. | 蛋白质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com