
(9分)
(1)3.6g H2O的物质的量是________,含有________mol H。
(2)在标准状况下,4g H2、11.2 L O2、1mol H2O中,所含分子数最多的是________,质量最大的是________。(填化学式)
(3)等质量的二氧化硫和三氧化硫,它们的物质的量之比为________,所含的硫原子数之比为________,所含的氧原子数之比为________。
(4)下列物质:①H2O ②石墨 ③NH4NO3 ④硫酸 ⑤ CH3COOH ⑥蔗糖 属于弱电解质的是 ;属于非电解质的是 (用编号填写)。
(1)0.2mol 0.4 (2)H2 H2O (3)5∶4 5∶4 5∶6(4)①⑤ ⑥
【解析】
试题分析:(1)3.6gH2O的物质的量为 ,含有0.4molH。
,含有0.4molH。
(2)标准状况下,4gH2的物质的量为 ,11.2LO2的物质的量为
,11.2LO2的物质的量为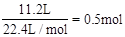 ,质量为16g,1molH2O的质量为18g。因此含分子数最多的是H2。质量最大的是H2O。
,质量为16g,1molH2O的质量为18g。因此含分子数最多的是H2。质量最大的是H2O。
(3)等质量的二氧化硫和三氧化硫,它们的物质的量之比为5∶4;所含的硫原子数之比为5∶4;所含的氧原子数之比为5∶6。
(4)弱电解质为:水、醋酸。非电解质为:蔗糖。
考点:物质的量与电解质综合
点评:电解质和非电解质都属于化合物,单质或混合物既不是电解质也不是非电解质。电解质主要包含酸碱盐和金属氧化物,非电解质主要包含有机物和大部分的非金属氧化物。强电解质包含强酸、强碱和大部分的盐类,弱电解质包含弱酸、弱碱和水。


科目:高中化学 来源: 题型:
(9分)(1)已知25℃、101kPa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| ΔH/( kJ·mol-1) | -283.0 | -285.8 | -726.5 |
请回答下列问题:①该条件下CH3OH(l)完全燃烧的热化学方程式为:__________________________。
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)===CH3OH(l)ΔH=____________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1
② CH3OH(g)+O2(g)=CO2(g)+2H2(g) △H2
已知H2(g)+ O2(g)===H2O(g) △H = -241.8 kJ·mol-1
则反应②的△H2 = kJ·mol-1。
(3)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省许昌部分学校高二上学期期末联考化学试卷(带解析) 题型:填空题
(9分)(1)已知25℃、101kPa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| ΔH/( kJ·mol-1) | -283.0 | -285.8 | -726.5 |
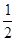 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2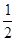 O2(g)===H2O(g) △H =" -241.8" kJ·mol-1
O2(g)===H2O(g) △H =" -241.8" kJ·mol-1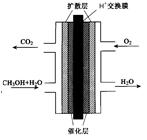
查看答案和解析>>
科目:高中化学 来源:2012届山东省诸城繁华中学高三下学期假期学习效果检测考试化学试卷 题型:填空题
(9分)(1)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
①温度为T1时,在0~tAmin内,H2的消耗速率
v (H2)=________________
②分析右图所示图像,下列说法正确的是_________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(2) 加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(3) 在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式 、 。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高一下学期期末考试化学试卷(解析版) 题型:填空题
(9分 ) (1)已知在 2L的容器中进行下列可逆反应,各物质的有关数据如下:
aA (g)+ bB (g)  2C(g)
2C(g)
起始物质的量(mol): 3 2 0
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则① a = ,b = ;
② 2S内B的反应速率= 。
(2) 1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO
反应的热化学方程式 。

查看答案和解析>>
科目:高中化学 来源:2013届河南省高二上学期期末联考化学试卷(解析版) 题型:填空题
(9分)(1)已知25℃、101kPa时,一些物质的燃烧热为:
|
化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
|
ΔH/( kJ·mol-1) |
-283.0 |
-285.8 |
-726.5 |
请回答下列问题:①该条件下CH3OH(l)完全燃烧的热化学方程式为:__________________________。
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)===CH3OH(l)ΔH=____________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1
② CH3OH(g)+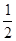 O2(g)=
CO2(g)+2H2(g) △H2
O2(g)=
CO2(g)+2H2(g) △H2
已知H2(g)+ 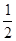 O2(g)===H2O(g)
△H = -241.8 kJ·mol-1
O2(g)===H2O(g)
△H = -241.8 kJ·mol-1
则反应②的△H2 = kJ·mol-1。
(3)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
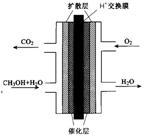
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com