
(2)已知硅酸为弱酸、硫酸为强酸,则磷酸可能是___________。
(3)锗的单质具有半导体的性质,请预测其最高价氧化物对应水化物的可能性质___________,并从不同的角度阐述你的理论根据:
①从周围元素的性质角度:____________。
②从周期表中的对角线规则角度:___________。
③其他根据。
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
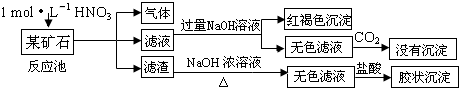
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com