
【题目】已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -26.7kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -50.75kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= -36.5 kJ·mol-1
则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为
A.+7.28kJ·mol-1B.7.28kJ·mol-1
C.+43.68kJ·mol-1D.43.68kJ·mol-1
科目:高中化学 来源: 题型:
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是___;(填编号)
A.CO32- B.ClO- C.CH3COO- D.HCO3-
(2)下列反应不能发生的是___;
A.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH=CH3COO- +HClO
C.CO32-+HClO=CO2↑+H2O+ClO-
D.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___;
A.c(CH3COOH)/c(H+)
B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/Kw
D.c(H+)/c(OH-)
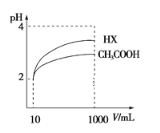
(4)体积为10 mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程pH变化如图所示,则HX的电离平衡常数__(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)___醋酸溶液中水电离出来的c(H+)。(填“大于”、“等于”或“小于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮是重要的氧化剂,存在如下平衡: 2NO2(g)![]() N2O4(g)。
N2O4(g)。
(1)已知:2NO2(g)![]() N2O4(g) △H=﹣57.20kJ·mol﹣1。一定条件下,在体积一定的密闭容器中反应2NO2(g)
N2O4(g) △H=﹣57.20kJ·mol﹣1。一定条件下,在体积一定的密闭容器中反应2NO2(g)![]() N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是_________(填字母)。
N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是_________(填字母)。
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L﹣1、c(N2O4)=0.0120mol·L﹣1,反应2NO2(g)![]() N2O4(g)的平衡常数K=__________。
N2O4(g)的平衡常数K=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量计算中和热。下列说法正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎泡沫塑料的作用是固定小烧杯
D. 酸或碱的物质的量越大,所测中和热的数值越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol;CO(g)+
O2(g)=CO(g) ΔH=-110.5 kJ/mol;CO(g)+![]() O2(g)=CO2(g) ΔH=-283kJ/mol,与这些碳完全燃烧相比,损失的热量是
O2(g)=CO2(g) ΔH=-283kJ/mol,与这些碳完全燃烧相比,损失的热量是
A.172.5kJB.1149kJ
C.283kJD.566kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮能形成多种氧化物、氢化物。
(1)已知:①![]()
②![]()
则![]() 与
与![]() 反应生成两种无毒气体的热化学方程式为_____________。
反应生成两种无毒气体的热化学方程式为_____________。
(2)使用高效催化剂可大大减少汽车尾气排放出的![]() 含量,某研究所的科研人员探究了
含量,某研究所的科研人员探究了![]() 时等质量的三种催化剂对
时等质量的三种催化剂对![]() 还原
还原![]() 的催化效果(其他条件相同),所得结果如图所示:
的催化效果(其他条件相同),所得结果如图所示:
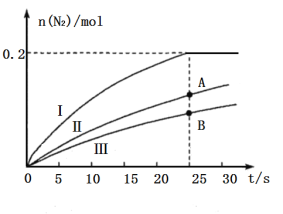
①如果不考虑催化剂价格,则使用催化剂______(填“Ⅰ”“Ⅱ”或“Ⅲ”)最好;A、B两状态下,生成![]() 的速率大小关系是___________。
的速率大小关系是___________。
②若容器容积为2L,开始时加入![]() 、
、![]() ,在催化剂Ⅰ的作用下达到如图所示平衡,则反应
,在催化剂Ⅰ的作用下达到如图所示平衡,则反应![]() 在该温度下的平衡常数
在该温度下的平衡常数![]() ______
______![]() 。
。
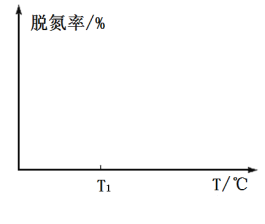
③在如图坐标系中画出使用催化剂Ⅰ(其他条件相同)时,25s时容器内反应的脱氮率(![]() 转化率)与温度的关系图___________。
转化率)与温度的关系图___________。
(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:![]() ,其速率方程式为
,其速率方程式为![]() (k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
①已知反应![]() ,在温度低于
,在温度低于![]() 时是由两个基元反应构成的复杂反应,该反应的速率方程式为
时是由两个基元反应构成的复杂反应,该反应的速率方程式为![]() ,则其两个基元反应分别为:Ⅰ.______
,则其两个基元反应分别为:Ⅰ.______![]() ______;Ⅱ.略,这两个反应中活化能较小的是__________。
______;Ⅱ.略,这两个反应中活化能较小的是__________。
②某科研小组测得![]() 时该反应的
时该反应的![]() 、
、![]() 生成
生成![]() 的速率
的速率![]() 的关系如下:
的关系如下:
| 0.025 | 0.05 | 0.025 |
| 0.04 | 0.04 | 0.12 |
|
|
|
|
则该温度下的反应速率常数![]() ______
______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:
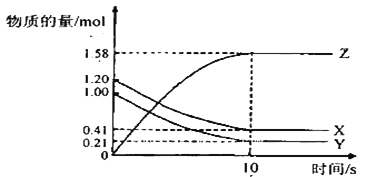
下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,![]() 固体在
固体在![]() 溶液中的
溶液中的![]() 比在
比在![]() 中的
中的![]() 大
大
B.恒温恒容的密闭容器中,某储氢反应:![]() ,当容器内气体压强保持不变时,反应达到化学平衡
,当容器内气体压强保持不变时,反应达到化学平衡
C.铝-空气燃料电池,以![]() 溶液为电解液时负极反应为:
溶液为电解液时负极反应为:![]()
D.常温下,相同浓度的碳酸钠与碳酸氢钠的混合溶液中离子浓度的大小顺序为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(![]() )是一种有机合成的中间体,下列关于M的说法正确的是( )
)是一种有机合成的中间体,下列关于M的说法正确的是( )
A.与苯互为同系物B.所有原子可能处于同一平面
C.二氯代物有16种(不含立体异构)D.![]() 燃烧最多消耗
燃烧最多消耗![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com