
| ������ | ����K+������Na+���� Cu2+����Al3+ |
| ������ | ����SO42-����HCO3-����NO3-����OH- |
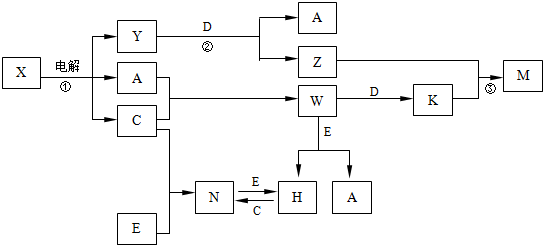
���� �ٽ���������ˮ��DΪ��ɫ��Һ��������Ϊ��ɫ��Һ����D�к���ͭ���ӣ�
�ڽ�E��Һ���뵽C��Һ�У����ְ�ɫ�����������μӳ����ܽ⣬��C�к��������ӣ�E�к������������ӣ�
�۽�����ɫ��Ӧʵ�飬ֻ��B��CΪ��ɫ������ɫ�ܲ���Ƭ������ֻ��B��C���м����ӣ�����E���������ƣ�
���ڸ���Һ�м���Ba��NO3��2��Һ���ټ������ϡ���ᣬA�зų���ɫ���壬��A�к���̼��������ӣ�C��D�в�����ɫ��������C��D�к�����������ӣ�����D������ͭ��C���������أ�
�ݽ�B��D����Һ��ϣ�δ���������������ɣ���B������أ�����A��̼�����ƣ��Դ������
��� �⣺��1���������Ϸ�����A��̼�����ƣ�E���������ƣ�����1mol A����Һ�뺬1mol E����Һ��Ӧ����̼���ƺ�ˮ�����ɺ���õ�һ�ֻ�����̼���ƣ�
�ʴ�Ϊ��Na2CO3 ��
��2�������Ӻ��������������ӷ�Ӧ������������������������������������������������Ʒ�Ӧ����ƫ�����ƣ���Ӧ���ӷ�Ӧ����ʽΪ��Al3++3OH-�TAl��OH��3����Al��OH��3+OH-�TAlO2-+2H2O��
�ʴ�Ϊ��Al3++3OH-�TAl��OH��3����Al��OH��3+OH-�TAlO2-+2H2O��
��3��C�к��������ӣ���������ˮ�����������������壬������������ԣ�������ˮ �е����������ˮ��ˮ�ⷴӦ����ʽΪ��Al3++3H2O?Al��OH��3�����壩+3H+��
�ʴ�Ϊ��Al3++3H2O?Al��OH��3�����壩+3H+��
���� ���⿼���������ƶϡ��������ʺͷ�Ӧ����ķ����жϣ���ȷ���ʵ������ǽⱾ��ؼ���ע�����ʼ�ķ�Ӧ����Ŀ�Ѷ��еȣ�


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶ȣ��棩 | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
| FeSO4��g/L�� | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| Al��OH��3 | Ga��OH��3 | |
| ��ʽ���볣��Ka | 2��10-11 | 1��10-2 |
| ��ʽ���볣��Kb | 1.3��10-33 | 1.4��10-34 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
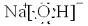 ������C���ʵ�Ԫ�������ڱ���λ�ڵ������ڵ�VIIA��
������C���ʵ�Ԫ�������ڱ���λ�ڵ������ڵ�VIIA���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȡ�÷�ĩ״��������С����ʱ��Ӧ��ҩ��ֽ�ۣ�ȡ�ÿ�״����ʱ��Ӧ�����Ӽ�ȡ | |
| B�� | ȡ��ϸ��ƿ�����Һʱ��������ƿ�������������ϣ�Ȼ���ǩ��������ƿ�ӣ�ƿ��Ҫ�������Թܿڣ���Һ�建���ص����Թ� | |
| C�� | ��ͷ�ι�ȡ��һ����Һ��ֱ��ȡ��һ�ֲ����䷴Ӧ����Һ | |
| D�� | ��ijʵ��û��ȷ��ҩƷ����˵��ʱ��Ϊ������������ȡ��ҩƷԽ��Խ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
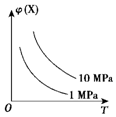
| A�� | N2��g��+3H2��g��?2NH3��g����H��0 | B�� | 2HI��g��?H2��g��+I2��g����H��0 | ||
| C�� | 4NH3��g��+5O2��g��?4NO��g��+6H2O��g����H��0 | D�� | C��s��+H2O��g��?H2��g��+CO��g����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �μӷ�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ3��2 | |
| B�� | �������ͱ���ԭ��Ԫ�طֱ�Ϊͭ�͵� | |
| C�� | ������0.2 mol����ʱ��ת�Ƶ���Ϊ0.6 mol | |
| D�� | ����ԭ��CuOռ���뷴ӦCuO��$\frac{1}{2}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
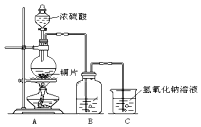 ��ͼΪ����ͭ��Ũ���ᷴӦ��װ�ã���ش�
��ͼΪ����ͭ��Ũ���ᷴӦ��װ�ã���ش��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com