

分析 用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉,利用装置A中的浓硫酸和草酸反应制备一氧化碳,制得的一氧化碳气体中含有二氧化碳、水蒸气,需要通过装置E吸收混合气体中二氧化碳,用浓硫酸除去混合气体中的水蒸气,得到干燥纯净的一氧化碳气体,通过装置D加热反应,用一氧化碳还原氧化铁生成铁和二氧化碳,利用装置B检验新生成的二氧化碳,据此连接装置实验,
(1)依据上述分析可知所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序AECDB;
(2)连接好仪器后需要先检验装置气密性,为防止生成的铁被氧化,酒精灯熄灭的顺序是先熄灭D处,再等到装置D冷却后熄灭A处酒精灯;
(3)装置B是验证生成的二氧化碳气体,装置E是除去一氧化碳中的二氧化碳;
(4)搅拌充分反应后过滤除去过量的铁粉得到纯净的氯化亚铁溶液;
(5)氯化亚铁溶液中水解生成氢氧化亚铁和盐酸,蒸发浓缩,促进水解不能得到氯化亚铁晶体.
解答 解:(1)依据上述分析可知所制气体流向从左向右时,利用装置A中的浓硫酸和草酸反应制备一氧化碳,制得的一氧化碳气体中含有二氧化碳、水蒸气,需要通过装置E吸收混合气体中二氧化碳,用浓硫酸除去混合气体中的水蒸气,得到干燥纯净的一氧化碳气体,通过装置D加热反应,用一氧化碳还原氧化铁生成铁和二氧化碳,利用装置B检验新生成的二氧化碳,上述组装的实验装置从左向右的实验装置连接顺序AECDB,
故答案为:A;E;C;D;B;
(2)反应是为了得到纯净的一氧化碳气体,气体发生装置在连接好仪器后需要先检验装置气密性,为防止生成的铁被氧化,酒精灯熄灭的顺序是先熄灭D处,再等到装置D冷却后熄灭A处酒精灯,
故答案为:连接好装置并检查气密性;A;
(3)上述分析可知装置B的作用是验证一氧化碳还原氧化铁生成的二氧化碳气体,装置E中氢氧化钠溶液是除去一氧化碳中的二氧化碳,避免干扰后续实验,
故答案为:检验新生成的CO2;除去一氧化碳中的二氧化碳;
(4)将制得的还原铁粉放入原混合溶液中,搅拌充分反应后过滤除去过量的铁粉得到纯净的氯化亚铁溶液,
故答案为:搅拌、过滤;
(5)氯化亚铁溶液中水解生成氢氧化亚铁和盐酸,蒸发浓缩,促进水解不能得到氯化亚铁晶体,需要在HCl气体氛围中加热浓缩,冷却结晶,抑制亚铁离子的水解,
故答案为:在HCl气体氛围中加热浓缩,冷却结晶.
点评 本题考查了物质制备实验过程分析,主要是气体制备、除杂,注意一氧化碳还原氧化铁完成后熄灭酒精灯的顺序,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 某工厂废水中含游离态氯,通过下列实验测定其浓度
某工厂废水中含游离态氯,通过下列实验测定其浓度查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用下图装置制取少量溴苯,试填写下列空白.
实验室用下图装置制取少量溴苯,试填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4的电子式: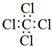 | B. | 乙烯的球棍模型 | ||
| C. | 乙酸的最简式:CH2O | D. | 丙烯醛的结构简式:CH2CHCHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com