
| A. | 原子半径:W>Z>Y | |
| B. | 元素W最高价氧化物的水化物为强酸 | |
| C. | 化合物X2Y、Z2Y中化学键的类型相同 | |
| D. | 元素Y的简单气态氢化物的热稳定性比W的弱 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小,则X为H元素;Y原子在周期表中处于族序数等于周期序数3倍的位置,只能处于第二周期,为VIA族元素,故Y为O元素;W与Y属于同一主族,则W为S元素;Z是最外层电子数最少的金属元素,处于IA族,原子序数大于氧,故Z为Na.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小,则X为H元素;Y原子在周期表中处于族序数等于周期序数3倍的位置,只能处于第二周期,为VIA族元素,故Y为O元素;W与Y属于同一主族,则W为S元素;Z是最外层电子数最少的金属元素,处于IA族,原子序数大于氧,故Z为Na.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Z(Na)>W(S)>Y(O),故A错误;
B.元素W最高价氧化物的水化物为硫酸,硫酸属于强酸,故B正确;
C.H2O只含有共价键,而Na2O只含有离子键,故C错误;
D.非金属性Y(O)>W(S),故元素Y的简单气态氢化物的热稳定性比W的强,故D错误,
故选:B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含有1个双键的直链有机物 | B. | 含2个双键的直链有机物 | ||
| C. | 含1个双键的环状有机物 | D. | 含一个叁键的直链有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 NaCl NaOH | B. | NaOH NaCl Na2CO3 | ||
| C. | NaCl NaOH Na2CO3 | D. | NaCl Na2CO3 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中水的离子积常数(KW)随溶液浓度的改变而改变 | |
| B. | 一般情况下,一元弱酸HA的Ka越大,表明该酸的酸性越弱 | |
| C. | 对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
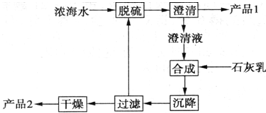 将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品.
将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com