
分析 在500℃下将CO和H2O各0.2mol的气态化合物充入2L的密闭容器中进行反应,达到平衡后,测得c(CO)═0.025mol•L-1,则平衡时CO为2L×0.025mol/L=0.05mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):0.2 0.2 0 0
变化量(mol):0.15 0.15 0.15 0.15
平衡量(mol):0.05 0.05 0.15 0.15
(1)反应前后气体体积不变,用物质的量代替浓度代入平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算;
(2)与原平衡相比,等效为降低压强,反应前后气体体积不变,平衡不移动,平衡时反应物转化率相等.
解答 解:在500℃下将CO和H2O各0.2mol的气态化合物充入2L的密闭容器中进行反应,达到平衡后,测得c(CO)═0.025mol•L-1,则平衡时CO为2L×0.025mol/L=0.05mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):0.2 0.2 0 0
变化量(mol):0.15 0.15 0.15 0.15
平衡量(mol):0.05 0.05 0.15 0.15
(1)反应前后气体体积不变,可以用物质的量代替浓度计算平衡常数,故平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=9,
答:该反应在500℃下的平衡常数为9.
(2)与原平衡相比,等效为降低压强,反应前后气体体积不变,平衡不移动,平衡时反应物转化率相等,故CO的转化率为$\frac{0.15mol}{0.2mol}$×100%=75%,
答:CO的转化率为75%.
点评 本题考查化学平衡计算,注意三段式解题法在化学平衡计算中应用,(2)中注意利用等效平衡进行解答,也可以利用平衡常数进行计算.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100mL溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色固体 | 1.248 | 133 | 300 | 0.04 | 24 | 溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\stackrel{合适的氧化剂}{→}$
$\stackrel{合适的氧化剂}{→}$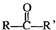 (注:R、R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化:
(注:R、R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化:
 .
. 或
或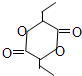 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题



| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇,乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇,笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇,乙醚等有机溶剂 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量CuSO4固体 | B. | 加入少量CH3COONa固体 | ||
| C. | 加入少量NH4HSO4固体 | D. | 加入少量Na2CO3固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com