
| A. | 0.2mol/L | B. | 0.1mol/L | C. | 0.3 mol/L | D. | 0.4mol/L |
分析 该反应中Na2SO3为还原剂,SO32-中的S被氧化,变为SO42-,XO4-为氧化剂,其中X元素化合价降低,根据氧化还原反应中得失电子守恒计算.
解答 解:该反应中Na2SO3为还原剂,SO32-中的S被氧化,变为SO42-,化合价从+4升到+6价,
XO4-为氧化剂,其中X元素化合价降低,开始为+7价,反应后降低到+1价,由得失电子守恒可知,c(Na2SO3)×0.03L×(6-4)=2×10-3 mol×(7-1),
则c(Na2SO3)=0.2mol/L.
故选A.
点评 本题考查了氧化还原反应的计算,题目难度不大,注意电子守恒在氧化还原反应计算中的应用,侧重于考查学生的分析能力和计算能力.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | X原子最外层电子数为5 | |
| B. | 当有3mol X2生成时,转移5mol电子 | |
| C. | 氧化产物和还原产物的物质的量之比为5:1 | |
| D. | “( )”括号中所填的微粒为X- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐水不会发生丁达尔效应 | |
| B. | 稀豆浆能通过半透膜 | |
| C. | 用氢氧化铁胶体进行电泳实验时,阴极(与电源负极相连)附近顔色加深,说明氢氧化铁胶体带正电 | |
| D. | 将装有淀粉溶液的半透膜袋浸入蒸馏水中,一段时间后往蒸馏水中滴入碘液,不变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
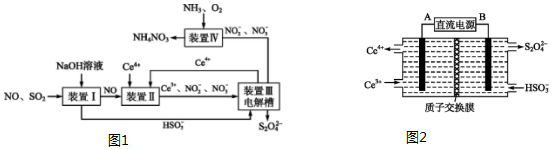
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl晶体 | B. | Zn粉 | C. | SO3固体 | D. | CuSO4晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com