
| A. | 除去FeCl2溶液中的FeCl3,可向溶液中加入足量铁粉,反应后过滤 | |
| B. | NaOH溶液和AlCl3溶液相互滴加的现象不同 | |
| C. | 用热的纯碱溶液洗碗可去除油污 | |
| D. | 将浓硫酸滴到白纸上,白纸变黑了,说明浓硫酸具有吸水性 |
分析 A.FeCl3可与铁反应生成FeCl2;
B.根据AlCl3+3NaOH═Al(OH)3↓+NaCl,AlCl3+4NaOH═NaAlO2+3NaCl+2H2O来分析;
C.加热可促进碳酸钠的水解,溶液碱性增强;
D.浓硫酸使纤维素碳化,为脱水的性质.
解答 解:A.FeCl3可与铁反应生成FeCl2,可用于除去杂质,故A正确;
B.将NaOH溶液分多次加到AlCl3溶液中,发生:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,将AlCl3溶液分多次加到NaOH溶液中,分别发生:Al3++4OH-=AlO2-+2H2O,Al3++3AlO2-+6H2O=4Al(OH)3↓,现象不同,故B正确;
C.加热可促进碳酸钠的水解,溶液碱性增强,可促进油脂的水解,故C正确;
D.浓硫酸使纤维素碳化,为脱水的性质,吸水性常用于干燥剂,故D错误.
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重学生的分析能力的考查,注意把握铁、铝的单质以及浓硫酸的性质,学习中注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28′ | |
| C. | NaCl晶体中与每个Na+距离相等且最近的Na+共有8个 | |
| D. | 区分晶体和非晶体最科学的方法是对固体进行X一射线衍射实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用电解饱和的MgCl2溶液的方法获得金属镁 | |
| B. | 电解CuSO4溶液精炼金属铜时,用铁做阳极 | |
| C. | 电解熔融Al2O3方法冶炼金属铝时,同时要加入冰晶石作助熔剂 | |
| D. | 工业上常采用活泼金属还原法冶炼金属银 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| C. | 做光导纤维的材料是单质硅晶体 | |
| D. | 将SO2通入溴水溶液中,溶液褪色,体现SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
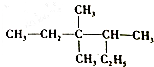
| A. | 2-乙基-3,3-二,甲基戊烷 | |
| B. | 3,3,4-三甲基己烷 | |
| C. | C的价电子轨道表示式:3,3-甲基-4乙基戊烷 | |
| D. | 2,3,3-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
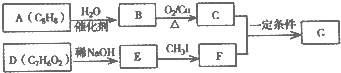
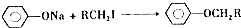

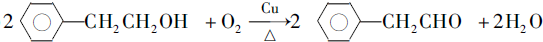 .
. .
.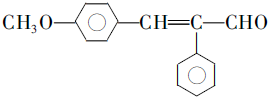 .
.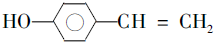 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论 |
| 取适量样品加热浓缩后加入试管中,再加入适量硫酸和铜片,加热. | 假设1成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com