
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A元素的一种原子没有中子,只有一个质子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成砖红色(红色)的E2O和EO两种氧化物 |
分析 A元素的一种原子没有中子,只有一个质子,则A为H元素;B是电负性最大的元素,则B为F元素;C的基态原子2p轨道有三个未成对电子,核外电子排布式为1s22s22p3,故C为N元素;E能形成砖红色(红色)的E2O和EO两种氧化物,则E为Cu;D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子,则D为Ca.
解答 解:A元素的一种原子没有中子,只有一个质子,则A为H元素;B是电负性最大的元素,则B为F元素;C的基态原子2p轨道有三个未成对电子,核外电子排布式为1s22s22p3,故C为N元素;E能形成砖红色(红色)的E2O和EO两种氧化物,则E为Cu;D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子,则D为Ca.
(1)E为Cu元素,核外电子数为29,核外电子排布式为1s22s22p63s23p63d10,原子基态时M层的电子排布式:3s23p63d10,故答案为:3s23p63d10;
(2)C元素单质为N2,结构式为N≡N,分子中含有δ和π键的键数之比为1:2,故答案为:1:2;
(3)乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
故答案为:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小;
(4)A、C、E三种元素可形成:Cu(NH3)42+配离子,Cu2+与NH3之间形成配位键,NH3分子中N原子与H原子之间形成极性共价键,没有金属键、非极性共价键、离子键、氢键,
若 Cu(NH3)42+具有对称的空间构型.且当 Cu(NH3)42+中的两个NH3分子被两个Cl取代时.能得到两种不同结构的产物,则 Cu(NH3)42+的空间构型为:平面正方形,
故答案为:①③;a;
(5)三硫化四磷分子中P原子形成3键,含有1对孤对电子,杂化轨道数目为4,则采取sp3杂化,与PO3-互为等电子体的化合物分子含有4个原子、价电子总数为24,该分子可以为SO3,三硫化四磷分子中P原子含有1对孤对电子,而S原子含有2对孤对电子,故0.1mol三硫化四磷分子中含有1mol孤对电子,即孤电子对数为NA,
故答案为:sp3;SO3;NA.
点评 本题是对物质结构与性质的考查,涉及元素推断、核外电子排布、化学键、分子结构与性质、杂化方式、等电子体等,注意对基础知识的理解掌握与灵活运用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量CO2通入溶液中:2NaCN+H2O+CO2=2HCN+Na2CO3 | |
| B. | 经测定CH3COONH4的水溶液呈中性可知:K(NH3•H2O)=1.75×10-5 | |
| C. | 将等物质的量浓度的CH3COONa与NaCN溶液等体积混合后的溶液中:c(CH3COO-)>c(CN-) | |
| D. | 常温下将10ml的PH=3的醋酸溶液稀释到100ml,其PH<4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | . 酸性高锰酸钾溶液 | B. | 溴水 | ||
| C. | 新制的氢氧化铜悬浊液 | D. | 氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
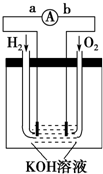 氢氧燃料电池是符合绿色化学理念的新型发电装置.
氢氧燃料电池是符合绿色化学理念的新型发电装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮化硅陶瓷--导热剂 | B. | Si和Ge--半导体材料 | ||
| C. | 钢化玻璃--汽车窗玻璃 | D. | SiO2--制光纤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵与八水合氢氧化钡反应 | |
| B. | 碳与水蒸气高温制取水煤气 | |
| C. | 氢氧化钾和硫酸中和 | |
| D. | 碳酸钙高温分解成氧化钙和二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com