
 X��Y��Z��W��QΪ���ֳ��������RΪ�������ʣ�X��Y��Z��Q����ɫ��Ӧ��Ϊ��ɫ��������W��R��Ϊ��ɫ��ζ���壮��ת����ϵ��ͼ��ʾ�����ַ�Ӧ����P��Ӧ��������ȥ��
X��Y��Z��W��QΪ���ֳ��������RΪ�������ʣ�X��Y��Z��Q����ɫ��Ӧ��Ϊ��ɫ��������W��R��Ϊ��ɫ��ζ���壮��ת����ϵ��ͼ��ʾ�����ַ�Ӧ����P��Ӧ��������ȥ��| 4.48L |
| 22.4L/mol |
| 1 |
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Na2S��Һ��c��Na+����c��S2-��֮�� |
| B����ͬ�¶��£�0.2mol/LCH3COOH��Һ��0.1mol/LCH3COOH��Һ��c��H+��֮�� |
| C��pH����7�İ�ˮ������淋Ļ����Һ��c��NH4+����c��SO4-��֮�� |
| D��pH=12��KOH��Һ��pH=12��Ba��OH��2��Һ��c��OH?��֮�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
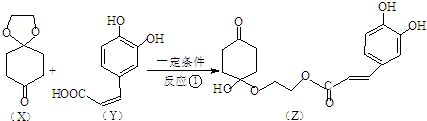
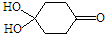 �����Ӽ���ˮ���ã�һ�������£�M����1��-OH����ȥ��Ӧ�õ��ȶ�������N������ʽΪC6H8O2������N�Ľṹ��ʽΪ
�����Ӽ���ˮ���ã�һ�������£�M����1��-OH����ȥ��Ӧ�õ��ȶ�������N������ʽΪC6H8O2������N�Ľṹ��ʽΪ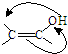
| �Զ����� |
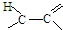 ����
����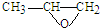 ���������Ʒ�Ӧ�ٵķ�Ӧ����������Ľṹ��ʽΪ
���������Ʒ�Ӧ�ٵķ�Ӧ����������Ľṹ��ʽΪ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1�����ɽ���Ԫ�������γɶ��������磺[Fe��H2NCONH2��6]��NO3��3[�����������غ�������]��Fe��CO��x�ȣ�
��1�����ɽ���Ԫ�������γɶ��������磺[Fe��H2NCONH2��6]��NO3��3[�����������غ�������]��Fe��CO��x�ȣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���۲���� | B������������ |
| C���ⶨ�ܶ� | D������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��3.53g |
| B��4.80g |
| C��5.04g |
| D��8.64g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������þͶ��������� Mg3N2+6H+�T3Mg2++2NH3�� |
| B�������軯����Һ������Һ�е�Fe3+��Fe3++3SCN-�TFe��SCN��3�� |
| C����˫��ˮ��ϡ���ᴦ��ӡˢ��·�壺Cu+H2O2+2H+�TCu2++2H2O |
| D������ͭ��Һ�еμӹ����İ�ˮ��Cu2++2 NH3?H2O�TCu��OH��2��+2NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������ü�Һϴ���������� |
| B����С�մ�����θ����� |
| C����Ư��������Ӿ�ص������� |
| D������ͭ��ƷӦҪ���ָ���Է����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com