
分析 (1)KClO3和Cl2的物质的量物质的量分别为xmol、ymol,根据电子转移守恒及氯元素守恒列方程计算解答;
(2)根据气体的总体积计算出及二氧化碳、CO的体积得出大气体积,根据N元素守恒得出硝酸钾的物质的量;设出硫磺的物质的量为x,然后利用C元素、K元素守恒列式计算出硫磺的物质的量及质量.
解答 解:(1)设KClO3和Cl2的物质的量物质的量分别为xmol、ymol,
根据电子转移守恒及氯元素守恒列方程,则:$\left\{\begin{array}{l}{6x+2y=0.12×0.4×5}\\{x+2y=0.1×0.6}\end{array}\right.$,
解得x=0.036、y=0.012,
所以产物KClO3和Cl2的物质的量之比为0.036:0.012=3:1,
故答案为:3:1;
(2)反应的化学方程式为3C+S+2KNO3═K2S+3CO2+N2(民间常说的一硫二硝三木炭),由题意知燃烧后生成33.6L(标准状况下)气体,剩余N2为11.2L,即为0.5mol,根据氮元素守恒可知反应的KNO3的物质的量为1mol,质量为101g;根据钾离子守恒可知硫酸钾和碳酸钾的总物质的量为0.5mol,
设该黑火药中硫黄的物质的量为x,则硫酸钾的物质的量为x,碳酸钾的物质的量为0.5-x,
又知气体中含碳元素为1mol,质量为12g,
则:101g+12g+32x+12(0.5-x)g=124g,解得x=0.5mol,
所以硫磺的质量为:32g/mol×0.5mol=8g,
故答案为:8.
点评 本题考查了混合物反应的计算、氧化还原反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法.


科目:高中化学 来源: 题型:选择题

| A. | 由红外光谱可知,该有机物的结构简式为CH3OH | |
| B. | 由核磁共振氢谱可知,该有机物分子中有3个氢原子 | |
| C. | 综合上述两种谱图分析,可以得知其A的相对分子质量 | |
| D. | 若A的化学式为C2H6O,则其结构简式为CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
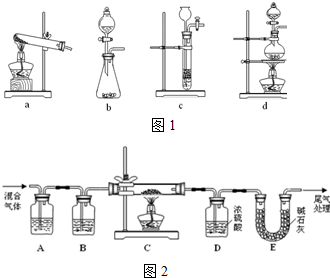
| 实验 编号 | 实验目的 | T/K | 催化剂用量/g | c/mol•l-1 | |
| KMnO4 | H2C2O4 | ||||
| Ⅰ | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| Ⅱ | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| Ⅲ | 323 | 0.5 | 0.01 | 0.1 | |
| Ⅳ | 探究催化剂对反应速率的影响 | 0.1 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①④ | C. | ②③ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去产物只有1种 的消去产物只有1种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=6.2×10-10 | K=4.2×10-7 | K=6.61×10-4 |
| A. | 氟化钠溶液中通入C02:2F-+H20+C02═2HF+CO32- | |
| B. | NaCN与HCN的混合溶液中:2c(Na+)═c(CN-)+c(HCN) | |
| C. | 25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者 | |
| D. | 25℃时CN-的水解平衡常数约为1.6×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,即可得到较纯净的FeCl3溶液 | |
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 | |
| C. |  准确量取9.50mL水 准确量取9.50mL水 | |
| D. | 1 mol 羟基中电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com