现有镁铝合金共3.9克,与500ml 2mol/L盐酸(足量)反应,生成的气体在标准状况下体积为4.48L,若反应后所得溶液的体积仍为500ml,求:
(1)求镁铝合金中铝的物质的量.
(2)求镁铝合金中镁的质量分数.
(3)求反应后溶液中Cl-的物质的量浓度.
解:(1)4.48L氢气的物质的量为
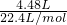
=0.2mol,
令金属中Mg的物质的量为xmol、Al的物质的量为ymol,则:
Mg+2HCl=MgCl
2+H
2↑,
xmol xmol
2Al+6HCl=2AlCl
3+3H
2↑
ymol 1.5ymol
所以

解得:x=0.05,y=0.1
答:3.9g合金中Al的物质的量为0.1mol;
(2)3.9g合金中Mg的质量为0.05mol×24g/mol=1.2g,镁铝合金中镁的质量分数=

×100%=30.8%,
答:合金中镁的质量分数为30.8%;
(3)Cl
-没有参加反应,Cl
-浓度不变,等于开始盐酸的浓度,故n(Cl
-)=2mol/L,
答:反应后溶液中Cl
-浓度为2mol/L.
分析:(1)发生反应Mg+2HCl=MgCl
2+H
2↑,2Al+6HCl=2AlCl
3+3H
2↑,4.48L气体是氢气,令金属中Mg的物质的量为xmol、Al的物质的量为ymol,结合二者质量与生成气体的体积,列方程计算x、y的值;
(2)根据m=nM计算合金中Mg的质量,镁铝合金中镁的质量分数=

×100%;
(3)Cl
-没有参加反应,Cl
-浓度不变,等于开始盐酸的浓度.
点评:考查混合物反应的有关计算,难度不大,清楚反应是解题的关键,注意基础知识掌握.

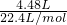 =0.2mol,
=0.2mol,
 ×100%=30.8%,
×100%=30.8%, ×100%;
×100%;
