

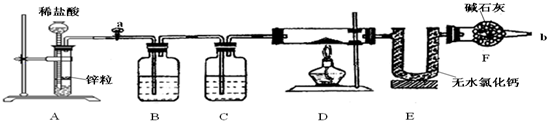
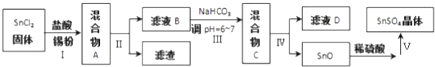
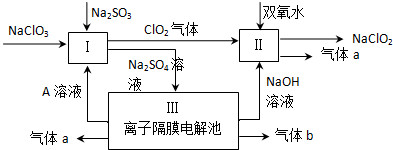
分析 由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3,在NCl3溶液中加入NaClO2发生氧化还原反应,可生成混合气体,再分离得ClO2和气体B,据此分析解答;
(1)电解NH4Cl、盐酸的溶液,氢离子放电生成氢气;
(2)电解时铵根离子失去电子,氢离子得到电子;结合信息可知NCl3防止分解及爆炸;
(3)NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气;
(4)由(3)可知,B为氨气,实验室利用铵盐与碱共热生成氨气;
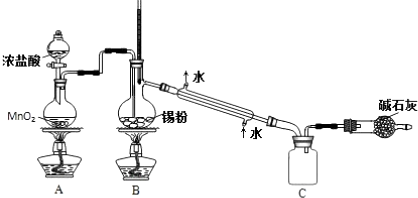
(5)ClO2氧化除去Mn2+生成MnO2,ClO2反应后的产物为ClO-2,以此书写离子方程式.
解答 解:(1)电解NH4Cl、盐酸的溶液,氢离子放电生成氢气,则A为H2,故答案为:H2;
(2)电解时铵根离子失去电子,氢离子得到电子,电解反应为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3,结合信息可知NCl3防止分解及爆炸,则还应控制好反应的温度,故答案为:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3;控制好反应的温度;
(3)NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气,则该反应的离子反应为NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑,故答案为:NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑;
(4)由(3)可知,B为氨气,实验室利用铵盐与碱共热生成氨气,该反应为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(5)ClO2氧化除去Mn2+生成MnO2,ClO2反应后的产物为ClO-2,该反应的离子方程式为Mn2++2ClO2+2H2O=MnO2↓+2ClO-2+4H+,
故答案为:Mn2++2ClO2+2H2O=MnO2↓+2ClO-2+4H+.
点评 本题考查物质的制备,明确流程中发生的电解反应及氧化还原反应是解答本题的关键,题目难度较大,注意信息的应用及流程的分析,(3)为解答的难点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 开始瞬间HCl、H2SO4、CH3COOH反应速率相等 | |
| B. | 至反应结束时CH3COOH中放出H2的总量最多 | |
| C. | 收集相同体积的H2的CH3COOH所用时间最长 | |
| D. | 至反应结束时HCl、H2SO4收集到H2的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1.0 L 1.0 mol•L-1KAlO2溶液中含有的氧原子数为2 NA | |
| B. | 7.8 g Na2O2固体中含有的阴离子数为0.2 NA | |
| C. | 标准状况下,体积为2.24 L的CO2和SO2的混合气体中含有的氧原子数为0.2 NA | |
| D. | 0.1 mol Cl2参加氧化还原反应,转移的电子数目一定是0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于碘在乙醇中的溶解度较大,所以可用乙醇把碘水中的碘萃取出来 | |
| B. | 可用加热蒸馏的方法使含水乙醇变为无水乙醇 | |
| C. | 由于汽油和水不互溶,因此可用分液的方法将二者分离 | |
| D. | NaCl的溶解度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl浓溶液中分离得到纯净的NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3是钠盐 | B. | Na2CO3是含氧酸盐 | ||
| C. | Na2CO3是碳酸盐 | D. | Na2CO3是碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com