
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满.下表是主要化合价及原子半径数据:
| A | B | C | D | E | F | |
| 主要化合价 | ﹣1 | ﹣3+5 | ﹣2+6 | ﹣1+7 | +2 | +1+2 |
| 原子半径 | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)B的氢化物中心原子采取 杂化,空间构型是 形,是 分子(填“极性”或“非极性”);
(3)F2+与NH3形成配离子的结构式为 + ;往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,可得到含有上述配离子的配合物.写出沉淀溶解的离子方程式 .
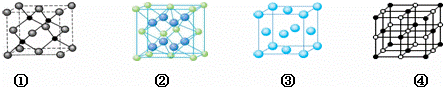
(4)A、E两种元素形成晶体晶胞是图中的 (填①、②、③或④);
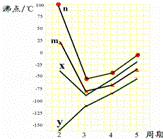
(5)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出C的氢化物所在的折线 (填n、m、x或y).
考点:
晶胞的计算;元素电离能、电负性的含义及应用;配合物的成键情况;原子轨道杂化方式及杂化类型判断.
专题:
原子组成与结构专题;化学键与晶体结构.
分析:
根据图表知,﹣1价的A、D元素处于第VIIA,且B原子序数小于D,所以A是F元素,D是Cl元素,A、B、C、D是短周期非金属元素,B、C、D同周期,﹣3、+5价的B元素处于第VA族且为第三周期,所以B是P元素,则C是S元素;E、F是第四周期的金属元素,F+的三个能层电子全充满,则F原子核外有29个电子,所以F是Cu元素,+2价的E属于第IIA、第四周期元素,所以E是Ca元素.
(1)同一周期元素的第一电离能随着原子序数的增大而增大,但第VIA族元素小于第VA族元素的第一电离能;
(2)根据其价层电子对互斥理论确定其空间构型、杂化方式,根据其结构确定其分子的极性;
(3)溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物;
(4)根据氟化钙的化学式确定其晶胞,氟化钙晶胞中含有一个钙离子、两个氟离子;
(5)硫处于第VIA元素,根据第二周期元素氢化物的沸点结合状态判断.
解答:
解:根据图表知,﹣1价的A、D元素处于第VIIA,且B原子序数小于D,所以A是F元素,D是Cl元素,A、B、C、D是短周期非金属元素,B、C、D同周期,﹣3、+5价的B元素处于第VA族且为第三周期,所以B是P元素,则C是S元素;E、F是第四周期的金属元素,F+的三个能层电子全充满,则F原子核外有29个电子,所以F是Cu元素,+2价的E属于第IIA、第四周期元素,所以E是Ca元素.
(1)同一周期元素的第一电离能随着原子序数的增大而增大,但第VIA族元素小于第VA族元素的第一电离能,所以B、C、D三种元素第一电离能数值由小到大的顺序是S<P<Cl,
故答案为:S<P<Cl;
(2)PH3分子P原子含有3个σ键一个孤电子对,所以采用Sp3杂化,其空间构型是三角锥形,该分子是不对称性结构,正负电荷中心不重合,所以是极性分子,
故答案为:Sp3;三角锥;极性;
(3)铜离子和氨分子形成配离子的结构式为[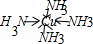 ]2+,溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物,反应方程式为Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH﹣+4H2O,
]2+,溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物,反应方程式为Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH﹣+4H2O,
故答案为:[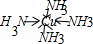 ]2+;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH﹣+4H2O;
]2+;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH﹣+4H2O;
(4)氟化钙的化学式为CaF2,氟化钙晶胞中含有一个钙离子、两个氟离子,
①晶胞中小黑色球,处于晶胞内部,数目为4,大灰色球数目为8×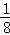 +6×
+6×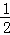 =4,原子数目之比为1:1,故错误;
=4,原子数目之比为1:1,故错误;
②晶胞中蓝色球数目为8,黄色球数目为8×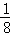 +6×
+6×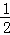 =4,原子数目之比为2:1,故正确;
=4,原子数目之比为2:1,故正确;
③由晶胞可知,只含1种原子,属于单质,故错误;
④晶胞中黑色球数目为8×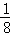 +6×
+6×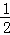 =4,白色球数目为1+12×
=4,白色球数目为1+12× =4,原子数目之比为1:1,故错误;
=4,原子数目之比为1:1,故错误;
故选②;
(5)C是S元素,处于ⅥA族,在ⅣA族、ⅤA族、ⅥA族、ⅦA族元素,第二周期元素形成的氢化物中,H2O通常为液体,沸点最高,故折线n表示第ⅥA族元素氢化物的沸点变化,故H2S所在的折线为n,故答案为:n.
点评:
本题考查元素的位置结构性质关系及应用,题目难度较大,本题从化合价角度来判断元素的种类,正确判断元素是解本题的关键,原子的杂化方式、分子的空间构型、氢键对物质沸点的影响是高考的热点,注意基础知识的积累.


科目:高中化学 来源: 题型:
溴被称为“海洋元素”,海水中的溴主要以NaBr
的形式存在。查阅资料得知:Br2的沸点为59℃,微溶于水,易溶于有机溶剂。实验室简单模拟从海水(此
处以低浓度的NaBr溶液代替)中提取溴单质的流程如图:


(1)写出实验操作的名称,操作① 、操作② ;
(2)在富集过程中,有如 下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
A.2NaBr+Cl2 = 2NaCl+Br2
B.2H2S+SO2 = 2H2O+3S↓
C.AlCl3+3NaAlO2+6H2O = 4Al(OH)3↓+3NaCl
D.Cl2 + 2NaOH = NaCl +NaClO + H2O
(3)实验前检测分液漏斗没有问题,但在操作 ①的步骤中,旋开分液漏斗下端的旋塞,却发现分液漏斗中的液体很难滴下,其原因是 ;
①的步骤中,旋开分液漏斗下端的旋塞,却发现分液漏斗中的液体很难滴下,其原因是 ;
(4)下列说法正确的是 。
A.操作①中,可以用酒精代替CCl4
B.操作②中,若发现忘了加碎瓷片,应该趁热补加
C.操作②中,温度计水银球应浸没在蒸馏烧瓶中液体的液面以下,但不能接触瓶底
D.操作②中,冷凝水流向应该是下进上出
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是中学化学中常见物质的转化关系,部分物质和反应条
件略去。
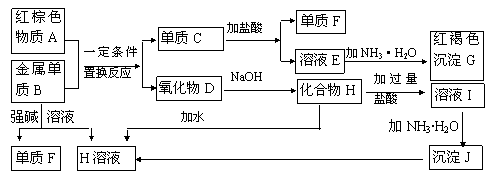

(1)单质F的化学式是________ ,写出物质A的一种用途 。
(2)写出单质B与强碱溶液反应的离子方程式 ,
写出由沉淀J生成 H溶液的离子方程式 ,
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式:
,白色沉淀L最终变为红褐色沉淀G,写出L变为G的化学反应方程式  。
。
(4)溶液I中所含金属离子是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于晶体的下列说法正确的是( )
①在晶体中只要有阴离子就一定有阳离子,只要有阳离子就一定有阴离子;②分子晶体的熔点一定比金属晶体的低;③晶体中分子间作用力越大,分子越稳定;④离子晶体中,一定存在离子键;⑤分子晶体中,一定存在共价键;⑥原子晶体中,一定存在共价键;⑦熔融时化学键没有破坏的晶体一定是分子晶体.
|
| A. | ②④⑥ | B. | ④⑤⑦ | C. | ④⑥⑦ | D. | ③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧时放出大量的热量.Al2H6球棍模型如图.下列说法肯定错误的是( )
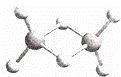
|
| A. | Al2H6在固态时所形成的晶体是分子晶体 |
|
| B. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 |
|
| C. | Al2H6在空气中完全燃烧,产物为氧化铝和水 |
|
| D. | Al2H6中含有离子键和极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是某太空空间站能量转化系统的局部示意图,基中燃料电池采用KOH为电解液,下列有关说法中正确的是( )
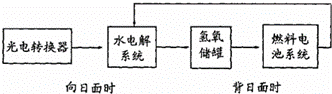
|
| A. | 该能量转化系统工作时,需不断补充H2O |
|
| B. | 该转化系统的能量本质上来源于太阳能 |
|
| C. | 水电解系统中的阴极反应:4OH﹣﹣4e﹣=O2+2H2O |
|
| D. | 燃料电池放电时的负极反应:H2﹣2e﹣=2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,将等物质的量的P与Q投入体积固定2L密闭容器中,发生反应2P(g)+Qg)⇌xW(g)+U(g),经5min后到达平衡,这5min内W的平均反应速率是0.2mol/(L•min),平衡时U的浓度为0.5mol/L,[P]:[Q]=1:2,下列说法中不正确的是( )
|
| A. | x值是2 |
|
| B. | P平衡转化率为66.7% |
|
| C. | 平衡常数为1 |
|
| D. | 反应前,Q的物质的量为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 电池放电时,电能转变为化学能 |
|
| B. | 直接燃烧煤比将煤进行处理转化为气体或液体燃料再燃烧效果好 |
|
| C. | 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 |
|
| D. | 所有燃烧反应都是放热反应,所以不需任何条件就可以进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com