
分析 (1)根据三行式来求平衡时各组分的浓度,然后代入表达式求解;求此时的浓度商与平衡常数的大小关系来判断移动方向;
(2)根据盖斯定律$\frac{1}{2}$②+③-$\frac{1}{2}$①可得目标反应CO(g)+2H2(g)?CH3OH(g),据此计算出该反应的△H.
解答 解:(1)反应2NO+2CO?2CO2 +N2达到平衡时各组分的浓度分别为:c(NO)$\frac{0.8mol}{0.5L}$=1.6mol/L,c(CO)=$\frac{0.3mol}{0.5L}$=0.6mol/L,c(CO2)=$\frac{0.2mol}{0.5L}$0.4mol/L,c(N2)=$\frac{0.1mol}{0.5L}$=0.2mol/L,则该反应的平衡常数为:K=$\frac{0.{4}^{2}×0.2}{1.{6}^{2}×0.{6}^{2}}$=$\frac{5}{144}$≈0.0347;
再向容器中充入CO、N2各0.3mol,此时的浓度商Qc=$\frac{0.{4}^{2}×0.8}{1.{6}^{2}×1.{2}^{2}}$=0.0347=K,所以平衡不移动,
故答案为:$\frac{5}{144}$或0.0347;不;
(2)①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1529kJ•mol-1;
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1;
③2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1;
根据盖斯定律,$\frac{1}{2}$②+③-$\frac{1}{2}$①可得:CO(g)+2H2(g)?CH3OH(g)△H=$\frac{1}{2}$×(-566.0kJ•mol-1)+(-571.6kJ•mol-1)-$\frac{1}{2}$(-1529kJ•mol-1)=-90.1kJ•mol-1,
故答案为:-90.1.
点评 本题考查了化学平衡常数的计算、盖斯定律的应用等知识,题目难度中等,明确化学平衡常数的概念及表达式为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
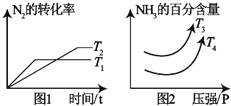 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:| 化学键 | N≡N | H-H | N-H |
| 键能/kJ/mol | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
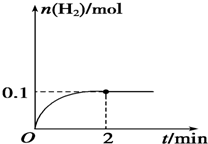 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 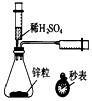 测定一定时间内生成H2的反应速率 | B. |  提取海带中的碘 | ||
| C. | 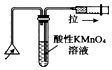 检验火柴燃烧产生的SO2 | D. | 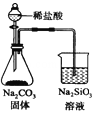 证明非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com