
右图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间。图(A)为温度一定时压强与反应速度的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是 ( )
A.N2O3(g) NO2(g)+NO(g) DH>0
NO2(g)+NO(g) DH>0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) DH<0
4NO(g)+6H2O(g) DH<0
C.3NO2(g)+H2O(l) 2HNO3(l)+NO(g) DH<0
2HNO3(l)+NO(g) DH<0
D.CO2(g)+C(s) 2CO(g) DH>0
2CO(g) DH>0

科目:高中化学 来源: 题型:
在80℃时,将0.4 mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol/L) | 0.20 | a | 0.10 | c | d | e |
| c(NO2)/(mol/L) | 0.00 | 0.12 | b | 0.22 | 0.24 | 0.24 |
(1)表中b c(填“<”、“=”或“>”)。
(2)20s时,N2 O4的的浓度为 mol/L,0-20s内N2O4的平均反应速率为 。
O4的的浓度为 mol/L,0-20s内N2O4的平均反应速率为 。
(3)N2O4(g) 2NO2(g)的平衡常数表达式K= ,在80℃时该反应的平衡常数K的数值为 。
2NO2(g)的平衡常数表达式K= ,在80℃时该反应的平衡常数K的数值为 。
(4)在其他条件相 同时,该反应的K值越大,表明建立平衡时 。
同时,该反应的K值越大,表明建立平衡时 。
A.N2O4的转化率越高 B.N2O4的体积分数越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
(5)该反应进行至100s以后将反应混合物的温度降低,发现气体的颜色变浅,则该反应是_______反应(填“吸热”或“放热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.食醋中含有乙酸,乙酸可由乙醇氧化得到
B.乙醇、乙酸乙酯、乙酸能用饱和碳酸钠溶液鉴别
C.乙酸、乙酸乙酯、葡萄糖和淀粉的最简式相同
D.生活中食用的食醋、植物油、动物蛋白等都是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学药品的贮存方法正确的是 ( )
A.新制氯水存放在带玻璃塞的无色细口瓶中
B.镁条保存在细口瓶中密闭保存
C.氢氧化钠固体保存在带橡胶塞的广口瓶中
D.少量金属钠保存在煤油、四氯化碳等有机溶剂中
查看答案和解析>>
科目:高中化学 来源: 题型:
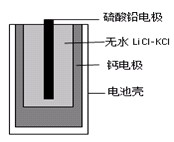
热激活电池可用作火箭、导弹的工作电。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池的总反应方程式为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。
下列有关说法正确的是 ( )
A.正极反应式:Ca +2Cl--2e-=CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1mol电子,理论上生成20.7gPb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中各微粒的浓度关系正确的是 ( )
A.室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+)
B.将10 mL 0.l mol·L-1 Na2CO3溶液逐滴滴加到10 mL 0.l mol·L-1盐酸中:
c(Na+) >c(Cl-) >c(HCO3-) >c(CO32-)
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+) = c(K+) = c(Ba2+)
D.0.2 mol·L-1的某一元弱酸HA溶液和0.l mol·L-1NaOH溶液等体积混合后的溶液:
2c(OH-) + c(A-) = 2c(H+) + c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.(1)现有pH相等、等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合恰好中和, 则V1、V2、V3的大小关系是 ;
现有物质的量浓度相等、等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液呈中性,则V1、V2、V3的大小关系是 ;
(2)常温下,将浓度为amol/L的氨水与浓度为bmol/L的盐酸等体积混合,恰好呈中性(溶液体积变化忽略不计),则氨水的电离平衡常数Kb=
(3)氨水和NH4Cl等物质的量混合配制成的稀溶液,c(Cl-)<c(NH4+),下列说法错误的是( )
A、氨水的电离作用大于NH4Cl的水解作用 B、氨水的电离作用小于NH4Cl的水解作用
C、氨水的存在抑制了NH4Cl的水解 D、NH4Cl的存在抑制了氨水的电离
E、 c(H+)>c(OH-) F、 c(NH3•H2O)>c(NH4+)
G、c(NH3•H2O)+c(NH4+)=2c(Cl-) H、c(NH3•H2O)+c(OH-)=c(Cl-)+c(H+)
Ⅱ.某种甲酸酯水解反应方程式为:
HCOOR (l) + H2O(l) HCOOH (l) +ROH (l) △ H > 0
HCOOH (l) +ROH (l) △ H > 0
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始浓度如下表:
| 组分 | HCOOR | H2O | HCOOH | ROH |
| 物质的量浓度/mol·L一1 | 1.00 | 1. 99 | 0.01 | 0.52 |
甲酸酯转化率在温度T1下随反应时间(t)的变化如下图:.
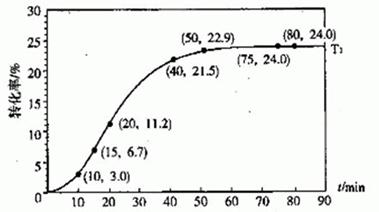
根据上述条件,计算不同时间范围内甲酸酯的平均反应速率,结果见下表:
| 反应时间/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均速率/10-3mol·L-1·min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
(1)T1温度下平衡体系中。c(ROH )为________ mol ·L一1
(2)15~20min范围内用甲酸酯表示的平均反应速率为________ mol ·L一1·min一1 ,(不要求写出计算过程)。
(3)根据题给数据分析,从影响反应速率的角度来看,生成物甲酸在该反应中还起到了_________的作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空:
(1)氯气能使湿润的淀粉KI试纸变 色。
(2)蒸馏实验中,加沸石的作用是 。
(3)5.4 g H2O所含氢原子数与 L (标准状况下)NH3所含氢原子数相等。
(4)以下物质:① NH3 ② CaCO3 ③ 蔗糖 ④ 饱和食盐水 ⑤ HNO3 ⑥ Cu
属于电解质的有 (填序号)。
(5)要除去某食盐晶体中的CaCl2、MgCl2、Na2SO4等杂质,有以下操作:
A、蒸发结晶 B、过滤 C、加入过量的Na2CO3溶液 D、加水溶解
E、加入过量的烧碱溶液 F、加入过量稀盐酸 G、加入过量的BaCl2溶液
正确的操作顺序是: → E → → →B → → A
(6)用单线桥或双线桥标出下列反应中电子转移的方向和数目:
MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
① 该反应中的氧化剂是 。
② 如反应中转移了0.2 mol电子,则产生的Cl2在标准状况下体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.标准状况下,22.4 L H2O含有的分子数为NA
B.常温常压下,1.06 g Na2CO3含有的Na+数为0.02 NA
C.通常状况下,NA个CO2分子占有的体积为22.4 L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com