
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性键;含有离子键的化合物属于离子化合物,只含有共价键的化合物属于共价化合物,据此分析解答.
解答 解:①HCl中只含极性共价键,属于共价化合物;
②CO2中只含极性共价键,属于共价化合物;
③H2O2中含H-O极性共价键,O-O非极性键,属于共价化合物;
④NH4Cl中含N-H极性共价键,铵根离子与氯离子形成离子键,属于离子化合物;
⑤Cl2中只含非极性共价键,属于单质;
⑥Na2O2中含O-O非极性共价键,钠离子与过氧根离子形成离子键,属于离子化合物;
⑦MgCl2中只含镁离子与氯离子形成的离子键,属于离子化合物,
(1)属于离子化合物的是④⑥⑦,属于共价化合物的是①②③,故答案为:④⑥⑦;①②③;
(2)只含非极性共价键的是⑤,既含有非极性键又含有极性键的是③,故答案为:⑤;③;
(3)既含有离子键又有共价键的是④⑥,故答案为:④⑥.
点评 本题考查了离子键、极性共价键、非极性共价键,离子化合物和共价化合物的判断,根据概念来分析解答即可,难度不大.


科目:高中化学 来源: 题型:推断题
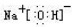 (写电子式,下同),既含有非极性共价键又含有离子键的化合物为
(写电子式,下同),既含有非极性共价键又含有离子键的化合物为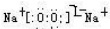 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | |
| B. | R与Q的电子数相差18 | |
| C. | 气态氢化物稳定性:R<T<Q | |
| D. | 最高价氧化物对应水化物的酸性:T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;反应②的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;
;反应②的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.2mol•L-1•min-1 | B. | v(NO2)=0.2mol•L-1•min-1 | ||
| C. | v(H2O)=0.005mol•L-1•s-1 | D. | v(N2)=0.005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
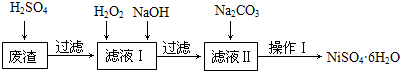
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应:元素化合价是否变化 | |
| B. | 共价化合物:是否含有共价键 | |
| C. | 强弱电解质:溶液的导电能力大小 | |
| D. | 氧化物:含氧化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大空气进入量或减小石油气进入量 | |
| B. | 增大空气进入量,增大石油气进入量 | |
| C. | 减小空气进入量,减小石油气进入量 | |
| D. | 减小空气进入量或增大石油气进入量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com