
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ/mol(燃烧热) | |
| B. | H2SO4(aq)+2NaOH (aq)═Na2SO4(aq)+2H2O (l)△H=-114.6kJ/mol(中和热) | |
| C. | S (s)+O2(g)═SO2 (g)△H=-296.8kJ/mol(燃烧热) | |
| D. | 2NO2═O2+2NO△H=+116.2kJ/mol(反应热) |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B、中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
D、热化学方程式是标注物质聚集状态,反应放出的热量.
解答 解:A、C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热)反应中生成的氧化物水是气体,不是稳定氧化物,故A错误;
B、H2SO4(aq)+2NaOH (aq)═Na2SO4(aq)+2H2O (l)△H=-114.6kJ/mol,生成2mol液态水,不符合中和热概念,故B错误;
C、S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(燃烧热)反应中生成的氧化物是稳定氧化物,符合燃烧热概念,故C正确;
D、2NO2=O2+2NO△H=+116.2kJ/mol(反应热),未标注物质聚集状态,故D错误;
故选C.
点评 本题考查了燃烧热、中和热、热化学方程式的书写方法和判断,关键是概念的理解,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 将“地沟油”变废为宝,可制成生物柴油和肥皂 | |
| B. | 福尔马林可浸制标本,利用了其使蛋白质变性的性质 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| D. | 绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 军舰船底镶嵌锌块作正极,以防船体被腐蚀 | |
| B. | “天宫二号”使用的碳纤维,是一种新型有机高分子材料 | |
| C. | 烈性炸药硝化甘油是由甘油(丙三醇)硝化制得,它属于酯类 | |
| D. | 蚊虫叮咬时释放出的蚁酸使人觉得不适,可以用肥皂水氧化蚁酸处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,含有6.02×1024个电子的重水(D2O)的质量约为18g | |
| B. | 常温下,0.5molAl与足量的盐酸反应,转移的电子数约为9.03×1022 | |
| C. | 标况下,17g NH3和22.4LH2O含有相同的电子数 | |
| D. | 50mL0.5mol/L Na2SO4溶液中所含的Na+数目和0.005mol F_所含电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等 | B. | 前者比后者大3倍 | ||
| C. | 后者是前者的1011倍 | D. | 后者是前者的108倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 微粒 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
 .
.
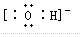 ,F粒子是
,F粒子是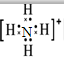 (用电子式表示).
(用电子式表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com