
【题目】以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。

①若从左端分别通入SO2和Cl2,装置A中观察到的现象 (填“相同”或“不相同”);若装置D中装的是V2O5(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,溶液颜色褪去,则该反应的离子方程式为 。
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入加量(填字母) ,能产生白色沉淀。
A.氨水 B.稀盐酸 C.硝酸钾溶液 D.氯化钠溶液
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为2∶3;当Cl2的与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
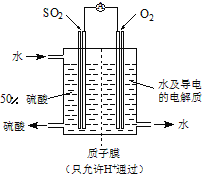
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为 极,其电极反应式为 ;电池的总反应式 。
【答案】(1)①相同 2SO2+O2![]() 2SO3;②SO2+I2+2H2O=4H++2I-+SO42-
2SO3;②SO2+I2+2H2O=4H++2I-+SO42-
(2)AC;
(3)Cl2+SO32-+H2O=SO42-+2Cl-+2H+;
(4)负;SO2 -2e-+2 H2O== SO42-+4H+; 2SO2+O2+2H2O=2H2SO4。
【解析】
试题分析:(1)①二氧化硫能和有色物质反应生成无色物质,所以二氧化硫有漂白性;氯气和水反应生成次氯酸,次氯酸具有强氧化性,能使有色物质褪色,所以若从左端分别通入SO2和Cl2,装置A中观察到的现象相同,都使品红褪色;若装置D中装的是V2O5(催化剂)。通入SO2时,打开K通入适量O2,它们会发生氧化还原反应产生SO3,该反应是可逆反应,所以反应的化学反应方程式为 2SO2+O2![]() 2SO3;②SO2通入B的碘水中,二者会发生氧化还原反应而使溶液颜色褪去,则该反应的离子方程式为SO2+I2+ 2H2O=4H++2I-+SO42-;(3)将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量试剂仍然无法观察到沉淀产生,说明不发生反应。A.氨水加入后生成亚硫酸铵,亚硫酸根和钡离子生成沉淀,正确;B.稀盐酸加入后不反应,错误;C.稀硝酸溶液具有强氧化性,将二氧化硫氧化成硫酸根,与钡离子生成硫酸钡沉淀,正确;D.氯化钙溶液和二氧化硫不反应,错误;(3) 若由元素S和O组成-2价酸根离子X,X中S和O的质量比为2:3,则二者的原子个数比是:1:3,该微粒是SO32-,当Cl2的与含X的溶液完全反应后,反应产生硫酸根离子积Cl-,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色BaSO4沉淀产生。Cl2与含X的溶液反应的离子方程式是Cl2+SO32-+H2O=SO42-+2Cl-+2H+;(4)利用电化学原理用SO2来制备硫酸,装置如图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2失去电子,发生氧化反应,所以通入SO2的电极为负极,其电极反应式为SO2 -2e-+2 H2O== SO42-+4H+;通入空气的电极为正极,氧气获得电子,与溶液的氢离子结合形成水,所以电池的总反应式是2SO2+O2+2H2O=2H2SO4。
2SO3;②SO2通入B的碘水中,二者会发生氧化还原反应而使溶液颜色褪去,则该反应的离子方程式为SO2+I2+ 2H2O=4H++2I-+SO42-;(3)将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量试剂仍然无法观察到沉淀产生,说明不发生反应。A.氨水加入后生成亚硫酸铵,亚硫酸根和钡离子生成沉淀,正确;B.稀盐酸加入后不反应,错误;C.稀硝酸溶液具有强氧化性,将二氧化硫氧化成硫酸根,与钡离子生成硫酸钡沉淀,正确;D.氯化钙溶液和二氧化硫不反应,错误;(3) 若由元素S和O组成-2价酸根离子X,X中S和O的质量比为2:3,则二者的原子个数比是:1:3,该微粒是SO32-,当Cl2的与含X的溶液完全反应后,反应产生硫酸根离子积Cl-,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色BaSO4沉淀产生。Cl2与含X的溶液反应的离子方程式是Cl2+SO32-+H2O=SO42-+2Cl-+2H+;(4)利用电化学原理用SO2来制备硫酸,装置如图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2失去电子,发生氧化反应,所以通入SO2的电极为负极,其电极反应式为SO2 -2e-+2 H2O== SO42-+4H+;通入空气的电极为正极,氧气获得电子,与溶液的氢离子结合形成水,所以电池的总反应式是2SO2+O2+2H2O=2H2SO4。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: 。
(2)实验结果表明,催化剂的催化效果与 有关。
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。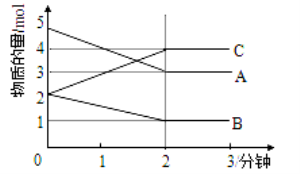
(3)该反应的的化学方程式为 。
(4)反应开始至2分钟时,B的平均反应速率为 。
(5)能说明该反应已达到平衡状态的是 。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(6)由图求得平衡时A的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(1) CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ·mol-1已知:H2(g)的燃烧热为285.8kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0kJ·mol-1,H2O(g)=H2O(l)
CH2=CH2(g)+4H2O(g) △H=akJ·mol-1已知:H2(g)的燃烧热为285.8kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0kJ·mol-1,H2O(g)=H2O(l)
△H=-44.0kJ·mol-1,则a=______kJ·mol-1。
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如图,下列有关说法不正确的是_______(填序号)

①温度越高,催化剂的催化效率越高
②温度低于250℃时,随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)2012年科学家根据光合作用原理研制出“人造树叶”。右图是“人造树叶”的电化学模拟实验装置图,该装置能将H2O和CO2转化为O2和有机物C3H8O。

阴极的电极反应式为::_________________________
II.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(4)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如下图:


①表中a=___________。
②实验说明,该反应是__________反应(填“放热”或“吸热”)。
③若在500℃时,投料=1,NO的转化率为80%,则此温度时的平衡常数K=_____。
(5)使用电化学法也可处理NO的污染,装置如右图。已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:__________。吸收池中除去NO的离子方程式为:__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图三条曲线表示C、Si和P元素的四级电离能变化趋势。下列说法正确的是( )
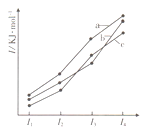
A. 电负性:c>b>a B. 最简单氢化物的稳定性:c>a>b
C. I5:a>c>b D. 最简单氢化物的沸点:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应3A(g)+B(g) ===2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L·min)、②vC=0.5 mol/(L·min)、③vB=0.5 mol/(L·min),三种情况下该反应速率由大到小的关系是 。(用序号表示)
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①该反应的化学方程式为____________________________。
②反应开始至2min,以气体Z表示的平均反应速率为 。
③2min反应达平衡容器内混合气体的平均相对分子质量比起 始时 (填“大”,“小”或“相等”下同),混合气体密度比起始时 。
④上述反应,在第2min时,X的转化率为 。
⑤将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X) = n (Y) = n (Z),则原混合气体中a : b =__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)按要求完成下列问题:
①甲基的电子式___________。
②写出制备TNT的化学反应方程式___________。
③反式2一丁烯的结构简式___________
(2)下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂填写在横线上:
①乙酸乙酯(乙醇)________;②甲苯(溴)________;
(3)下列卤代烃既能发生消去反应生成烯烃,又能发生水解反应生成醇的是
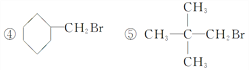
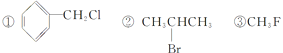

(4)实验室用纯溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作进行提纯:①蒸馏 ②水洗 ③用干燥剂干燥 ④10%NaOH溶液洗正确的操作顺序是 。
(5)某高聚物的结构式如图: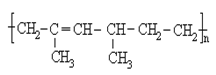 其单体的名称为
其单体的名称为
(6)某有机物的结构简式为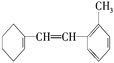 据此填写下列空格。
据此填写下列空格。
①该物质苯环上一氯代物有________种;
②1mol该物质和溴水混合,消耗Br2的物质的量为________mol;
③1mol该物质和H2加成需H2________mol;
(7)![]() 与等物质的量的Br2发生加成反应,生成的产物是
与等物质的量的Br2发生加成反应,生成的产物是


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围广。请回答下列问题:
(1)制备硅半导体材料必须先得到高醇硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意图如下:
![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式 .
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种物质。写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混O2,可能引起的后果是 .
(2)下列有关硅材料的说法正确的是 (填字母)。
A.高纯度的硅,可用于生产光电池,将光能直接转换为电能
B.氮化硅硬度大.熔点高.可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料----光导纤维
D.普通玻璃是由纯碱.石灰石和石英砂制成的
E.盐酸可以与硅反应.故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃,取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 。D的最高价氧化物的水化物是 。
(2)写出A、B的化合物与E反应的化学方程式: 。
(3)A、B两元素形成化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8gCO2和7.2gH2O。下列说法正确的是
A.该化合物仅含碳、氢两种元素
B.该化合物中碳、氢原子个数比为1:4
C.无法确定该化合物是否含有氧元素
D.该化合物一定是C2H8O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com