
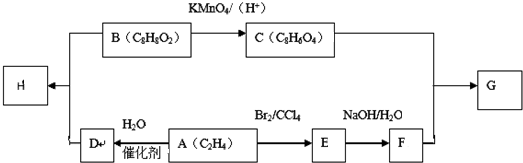
| A、1:3 | B、2:3 |
| C、1:1 | D、4:3 |
| +4 |
| Pb |
| +2 |
| Pb |
| +3 |
| Cr |
| +6 |
| Cr |
| +4 |
| Pb |
| +2 |
| Pb |
| +3 |
| Cr |
| +6 |
| Cr |


科目:高中化学 来源: 题型:
| A、在熔化状态下能导电的化合物为离子化合物 |
| B、根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 |
| C、CO2、SiO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物 |
| D、因为Na2O的水溶液能导电,所以Na2O是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
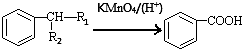 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ | ||||
| 阴离子 | OH- Cl- C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.
氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.| n(NH3) |
| n(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com