
【题目】由NO和CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29),下列关系正确的是( )
A. 混合气体中,CO与NO质量比15:14
B. 混合气体中,CO与NO分子个数比1:2
C. 混合气体中CO占有的体积大于NO占有的体积
D. 混合气体中,CO与NO密度比14:15
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的数值,下列说法正确的是
A. 常温下7.2gCaO2晶体中阴离子和阳离子总数为0.3NA
B. 1mol/L的氯化铁溶液中,若CI-的数目为3NA,则Fe3+的数目为NA
C. 反应3H2(g)+N2(g)2NH3(g) ΔH=-92KJ/mol,当放出热量9.2KJ时,转移电子0.6NA
D. 标准状况下,11.2L三氯甲烷中含有含极性共价键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答) ,含有共价键的共价化合物是(用序号回答) 。
(2)当其熔化时,不破坏化学键的是(用序号回答) 。
(二)写出下列物质或微粒的电子式:
H2O: Na2O: CO2:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序 .
(2)ZW2的电子式是 .
(3)实验室制备Y的最高价氧化物的水化物的离子方程式是
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
(5)0.1mol的单质W与50mL 1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br﹣的物质的量之比是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
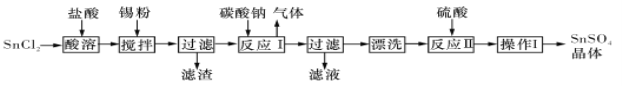
查阅资料:
A.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
B.SnC12易水解生成碱式氯化亚锡
回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:___________。
(2)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(3)反应I得到沉淀SnO,得到该沉淀的离子反应方程式是____________。
(4)操作I是____________。
II.已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol/L。若在10 mL含有KCl和KI各为0.01 mol/L的溶液中,加入16 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
c(K+)>c(NO![]() )>c(Cl-)>c(Ag+)>c(I-)
)>c(Cl-)>c(Ag+)>c(I-)
B .c(K+)>c(NO![]() )>c(Ag+)>c(Cl-)>c(I-)
)>c(Ag+)>c(Cl-)>c(I-)
C.c(K+)>c(NO![]() )>c(Ag+)=c(Cl-)+c(I-)
)>c(Ag+)=c(Cl-)+c(I-)
D.c(NO![]() )>c(K+)>c(Ag+)>c(Cl-)>c(I-)
)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的知识说法正确的: ( )
A. Fe(OH)3的胶体是带有正电荷,所以通上直流电后会发生电泳现象
B. 用丁达尔现象可鉴别氯化钠的溶液和淀粉溶液
C. 在沸水中加入饱和FeCl3溶液制取胶体化学方程式为:FeCl3+H2O=Fe(OH)3↓+3HCl
D. 用过滤的方法可以分离溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( )
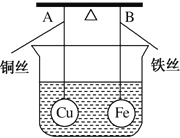
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用药品羟苯水杨胺的合成路线如下。

已知:① ;
;
② ;
;
③当苯环上连有羧基,在苯环上引进的新取代基易进入羧基的间位。
回答下列问题:
(1)羟苯水杨胺的分子式为______,F含有的官能团名称是________。
(2)A的名称为___________。
(3)A→B所需试剂为______;D→E的反应类型属于_________。
(4)B→C反应的化学方程式为_____________。
(5)F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应的共有_____种,其中能发生水解反应,核磁共振氢谱显示4组峰,其峰面积之比为l:2:2:1的同分异构体的结构简式是__________。
(6)写出以甲苯为原料(其他无机试剂任选)制备高聚物![]() 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
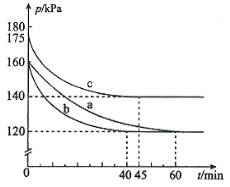
① 图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、c 。
②用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 ;实验a平衡转化率:α(a)为 。
(2)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com