
(10分)实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
Ⅰ.配制100mL 0.10mol/L NaOH标准溶液。
Ⅱ.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
Ⅲ.重复上述滴定操作2~3次,记录数据如下。
|
实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) |
待测盐酸溶液的体积 (mL) |
|
1 |
0.10 |
22.62 |
20.00 |
|
2 |
0.10 |
22.72 |
20.00 |
|
3 |
0.10 |
22.80 |
20.00 |
(1)滴定达到终点的现象是 ① ,此时锥形瓶内溶液的pH范围为 ② 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
(3)排去碱式滴定管中气泡的方法应采用下图 的操作,然后挤压玻璃球使尖嘴部分充满碱液。

甲 乙 丙
(4)在上述实验中,下列操作(其它操作正确)会造成测定结果偏高的有 (多选扣分)。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)①最后一滴氢氧化钠溶液加入,溶液由无色恰好变浅红色,且半分钟内不褪色 ②8.2~10
(2)0.11mol/L(不写单位扣1分) (3)丙 (4)EF
【解析】
试题分析:(1)滴定达到终点的现象是最后一滴氢氧化钠溶液加入,溶液由无色恰好变浅红色,且半分钟内不褪色。酚酞的变色范围为8—10,所以此时锥形瓶内溶液的pH范围为8—10。
(2)滴入NaOH的体积为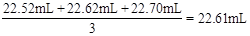 ,所以c(HCl)=
,所以c(HCl)= =
0.11mol/L。
=
0.11mol/L。
(3)碱式滴定管排气泡的方式是向上挤压滴管头,因此选丙。
(4)根据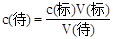 ,滴定终点读数时俯视读数,标准液的体积比正常值小,所以偏低;酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,待测液的浓度变小,所用标准液的体积比正常值小,所以偏低;锥形瓶水洗后未干燥,对滴定结果无影响;配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中,标准液的浓度变大,标准液的体积比正常值小,所以偏小;配制NaOH标准溶液时,定容时仰视容量瓶的刻度线,标准液的浓度变小,,标准液的体积比正常值大,所以偏大;碱式滴定管尖嘴部分有气泡,滴定后消失,标准液的体积比正常值大,所以偏大。因此选EF。
,滴定终点读数时俯视读数,标准液的体积比正常值小,所以偏低;酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,待测液的浓度变小,所用标准液的体积比正常值小,所以偏低;锥形瓶水洗后未干燥,对滴定结果无影响;配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中,标准液的浓度变大,标准液的体积比正常值小,所以偏小;配制NaOH标准溶液时,定容时仰视容量瓶的刻度线,标准液的浓度变小,,标准液的体积比正常值大,所以偏大;碱式滴定管尖嘴部分有气泡,滴定后消失,标准液的体积比正常值大,所以偏大。因此选EF。
考点:酸碱中和滴定
点评:酸碱中和滴定误差分析时,将所有的情况都转变成标准液的体积与正常值的比较。


科目:高中化学 来源: 题型:阅读理解
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.02 | 20.00 |
| 2 | 0.10 | 20.00 | 20.00 |
| 3 | 0.10 | 19.00 | 20.00 |
| 4 | 0.10 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |

查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省兰州一中高二上学期期末考试化学试卷(带解析) 题型:填空题
(10分)实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
Ⅰ.配制100mL 0.10mol/L NaOH标准溶液。
Ⅱ.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
Ⅲ.重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

查看答案和解析>>
科目:高中化学 来源:2015届四川省高二上学期第三次月考化学试卷(解析版) 题型:填空题
Ⅰ. 在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O  2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液后,溶液呈 色,因为 。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,则溶液呈 色,因为 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡向 方向移动,溶液颜色将 。(填“变深”、“变浅”或“不变”)
Ⅱ.实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
1.配制100mL 0.10mol/L NaOH标准溶液。
2.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
3.重复上述滴定操作2~3次,记录数据如下。
|
实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) |
待测盐酸溶液的体积 (mL) |
|
1 |
0.10 |
22.62 |
20.00 |
|
2 |
0.10 |
22.58 |
20.00 |
|
3 |
0.10 |
22.60 |
20.00 |
(1)滴定达到终点的现象是 ,此时锥形瓶内溶液的pH范围为 。
(2)根据上述数据,可计算出该盐酸的浓度约为 。
(3)排去碱式滴定管中气泡的方法应采用下图 的操作,然后挤压玻璃球使尖嘴部分充满碱液。



甲 乙 丙
(4)在上述实验中,下列操作(其它操作正确)会造成测定结果偏高的有 (多选扣分)。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com