
甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同。下列判断不正确的是( )
A.乙元素的族序数比甲元素的族序数大
B.甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙
C.原子半径的大小:甲>乙
D.含乙元素的化合物数目比含甲或丙元素的化合物数目多
科目:高中化学 来源: 题型:
下列有关实验现象叙述,错误的是
A.氢气在氯气中燃烧产生苍白色火焰
B.金属钠长期暴露在空气中变成黄色
C.钠在氯气中燃烧产生白烟
D.过氧化钠投入水中生成的气体能使带火星的木条复燃
查看答案和解析>>
科目:高中化学 来源: 题型:
下列原子结构的叙述中正确的是( )
A.所有的原子核都是由质子和中子组成的
B.原子的最外层电子数不超过8个
C.稀有气体原子的最外层电子数均为8
D.原子的次外层电子数一定都是8
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组化合物的性质比较,不正确的是( )
A.金属性:Li<Na<K
B.沸点:HF<HCl<HBr<HI
C.稳定性:HCl>H2S>PH3
D.还原性:F-<Cl-<Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。
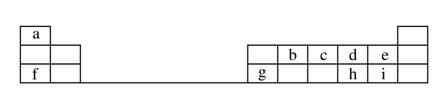
回答下列问题:
(1)元素b在元素周期表中的位置是________。
(2)元素a与c形成的4核10电子分子的化学式为________,其水溶液呈________性。
(3)元素e的负一价离子的结构示意图为________,元素g的简单离子的结构示意图为________,二者的离子半径大小顺序为________。
(4)元素i的气态氢化物比元素e的气态氢化物________(填“稳定”或“不稳定”)。
(5)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为______________,该化合物中所含的化学键类型为________________。
(6)元素d与h形成的化合物的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,5.6 L CH4含C—H键数目为NA
B.常温常压下,100 g 17% H2O2水溶液含氧原子总数为NA
C.标准状况下,5.6 L O2与适量Na加热反应,转移电子数一定为NA
D.常温常压下,14 g乙烯与丙烯的混合气体,含碳原子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
120℃、101.3kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A.2∶1 B.1∶2 C.1∶7 D.7∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。

已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
II.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是 。(2)吸收塔中的原料B可以选用 (填字母序号)。
a.NaCl溶液 b.Na2CO3溶液 c.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3 的过程(加热装置已略去)。
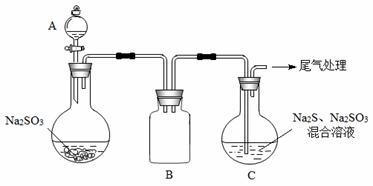
① A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是 。装置B的作用是 。
② C中制备Na2S2O3发生的连续反应有:Na2S + H2O + SO2 ===Na2SO3 +H2S、
和 。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com