
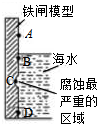
 铁及其化合物与生产、生活关系密切,
铁及其化合物与生产、生活关系密切,分析 (1)①电解质为海水,不是较强酸性溶液,应为吸氧腐蚀;
②海水与氧气接触,与Fe最易形成原电池,发生的吸氧腐蚀的程度最大,生成铁锈最多;
(2)已知:①Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H=-272kJ•mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
③2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
根据盖斯定律,②-③×$\frac{1}{2}$-①可得:FeO(s)+CO(g)=Fe(s)+CO2(g).
解答 解:(1)①海水溶液不是较强酸性溶液,则钢铁发生吸氧腐蚀,故答案为:吸氧腐蚀;
②钢铁接触空气、水时发生的吸氧腐蚀的程度最大,生成铁锈最多,所以B生成铁锈最多,故答案为:B;
(2)已知:①Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H=-272kJ•mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
③2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
根据盖斯定律,②-③×$\frac{1}{2}$-①可得:FeO(s)+CO(g)=Fe(s)+CO2(g),
则△H=-393.5kJ•mol-1-$\frac{1}{2}$×(-221kJ•mol-1)-(-272kJ•mol-1)=-11kJ•mol-1,
故答案为:-11 kJ•mol-1.
点评 本题考查金属腐蚀、运用盖斯定律计算反应热,难度不大,理解金属的析氢腐蚀和吸氧腐蚀,理解盖斯定律.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某“焰色反应”的焰色结果为黄色,则样品中一定含“Na”元素,未必不含“K”元素 | |
| B. | 做“焰色反应”实验时,如果没有铂丝,可用铁丝代替 | |
| C. | “焰色”是金属单质或其离子燃烧时体现出来的火焰颜色 | |
| D. | 做“焰色反应“实验时,用于清洗铂丝的酸宜选用盐酸,不宜选用硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着反应的进行,容器内压强始终不变 | |
| B. | 及时地分离出N2或CO2,正反应速率加快 | |
| C. | 升高温度(其它条件不变),可提高反应物的转化率 | |
| D. | 使用不同催化剂(其它条件不变),该反应的平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| B. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| C. | 只含有离子键的化合物才是离子化合物 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g Na2O2中离子总数为0.4NA | |
| B. | 标准状况下,11.2L CCl4的分子数为0.5NA | |
| C. | 常温常压下,48 g O2和O3的混合气体中含有的氧原子数为3NA | |
| D. | 1mol•L-1MgCl2溶液中含有氯离子个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNaOH溶液中:Na+、K+、Ca2+、HCO3- | |
| B. | 无色溶液中:H+、Fe2+、Al3+、NO3- | |
| C. | 与铝产生氢气的溶液中:NH4+、Cl-、Mg2+、SO42- | |
| D. | pH>7的溶液中:Na+、K+、AlO2-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com