
【题目】乳酸(![]() )是一种化合物,在多种生物化学中起作用。利用乳酸为原料,可以合成某芳香族功能高分子材料H,回答下列问题。
)是一种化合物,在多种生物化学中起作用。利用乳酸为原料,可以合成某芳香族功能高分子材料H,回答下列问题。

(1)下列关于乳酸的说法正确的是_________
A.乳酸属于氨基酸 B. lmol乳酸能与2molNaOH反应
C.乳酸能溶于水 D.可以利用红外光谱法鉴别乳酸与丙酸
(2)A→B的反应类型是______________,C→D的反应类型是__________________。
(3)化合物B的系统命名是_____________,化合物G的结构简式是______________。
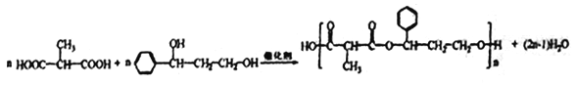
(4)某芳香族功能高分子材料H是由B、G发生反应合成的,写出该过程的化学方程式:_________________________________________。
(5)某芳香化合物W是化合物F的同分异构体,W能发生银镜反应,且能发生水解反应,则W的结构有_______种,其中核磁共振氢谱峰数最少的结构简式是_______________ (任写一种)。
(6)布洛芬是一种常用药物,主要成分的结构简式是 。现以有机原料2-甲基丙烯和苯乙酮(
。现以有机原料2-甲基丙烯和苯乙酮( ),设计合成路线以制备
),设计合成路线以制备 ,无机试剂任用(已知R-X也可以发生类似C→D的反应)。
,无机试剂任用(已知R-X也可以发生类似C→D的反应)。
_______________________________________________________________。
【答案】 CD 加成反应 取代反应 2-甲基丙二酸 或甲基丙二酸 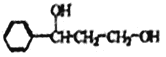
 14
14 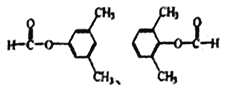
【解析】本题考查有机物的合成和推断,(1)A、氨基酸是含有氨基和羧基,而乳酸含有羟基和羧基,乳酸不是氨基酸,故A错误;B、1mol乳酸含有1mol羧基,因此1mol乳酸消耗1molNaOH,故B错误;C、乳酸中含有羧基和羟基,都是亲水基团,即乳酸溶于水,故C正确;D、丙酸的结构简式为CH3CH2COOH,丙酸和乳酸含有结构不同,因此通过红外光谱法可以鉴别乳酸与丙酸,故D正确;(2)乳酸中的羟基与碳相连的键断裂,CO叁键中的一个键断裂,生成B,发生反应类型是加成反应,根据E的结构简式,推出C的结构简式为CH2=CHCOOH,D生成E,去掉1个HCl,说明D中含有氯原子,因此C→D发生取代反应;(3)根据羧酸的命名,B的名称为2-甲基丙二酸;根据问题(4)H是由B和G形成的高分子化合物,且H为芳香族化合物,即G中含有苯环,因此F与氢气发生加成反应,氢气只与F中羰基发生加成反应,即G的结构简式为: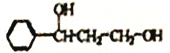 ;(4)B和G通过缩聚反应生成H,即反应方程式为:
;(4)B和G通过缩聚反应生成H,即反应方程式为: ;(5)能发生银镜反应,说明含有醛基,能发生水解,说明是甲酸某酯的形式,符合条件的同分异构体有:
;(5)能发生银镜反应,说明含有醛基,能发生水解,说明是甲酸某酯的形式,符合条件的同分异构体有: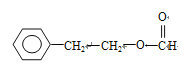 、
、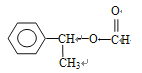 、
、 (邻间对三种)、
(邻间对三种)、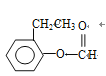 (邻间对三种)、
(邻间对三种)、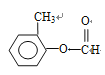 (另一个甲基在苯环上4种位置进行取代)、
(另一个甲基在苯环上4种位置进行取代)、 (另一个甲基在苯环上有2种位置进行取代),共有14种形式,核磁共振氢谱的峰最少,说明是对称结构,即符合条件的是:
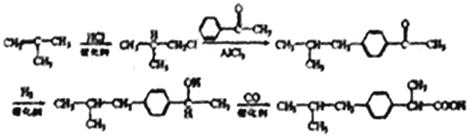
(另一个甲基在苯环上有2种位置进行取代),共有14种形式,核磁共振氢谱的峰最少,说明是对称结构,即符合条件的是: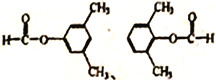 ;(6)根据目标产物,以及R-X也能发生类似C→D的反应,2-甲基丙烯与HCl发生加成反应生成(CH3)2CH-CH2Cl,在AlCl3条件下与苯乙酮发生反应,生成
;(6)根据目标产物,以及R-X也能发生类似C→D的反应,2-甲基丙烯与HCl发生加成反应生成(CH3)2CH-CH2Cl,在AlCl3条件下与苯乙酮发生反应,生成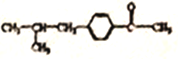 ,在催化剂的作用与氢气发生加成反应,生成
,在催化剂的作用与氢气发生加成反应,生成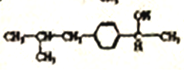 ,最后与CO发生反应,生成目标产物,合成路线为:
,最后与CO发生反应,生成目标产物,合成路线为: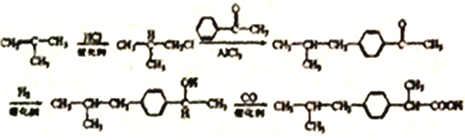 。
。


科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,正确的是( )
A. 乙酸乙酯、油脂、糖类、蛋白质都可以发生水解反应
B. 乙烯和聚丙烯都能与氢气在一定条件下发生加成反应
C. 油脂在碱性条件下可发生水解,工业上利用该反应生产肥皂
D. 乙烯、苯、乙醇均能使紫色的酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
A. CH4和NH![]() 是等电子体,键角均为60°
是等电子体,键角均为60°
B. B3N3H6和苯是等电子体,B3N3H6分子中存在“肩并肩”式重叠的轨道
C. H3O+和PCl3是等电子体,均为平面三角形结构
D. NO![]() 和CO
和CO![]() 是等电子体,均为三角锥形结构
是等电子体,均为三角锥形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种军用烟幕弹中装有ZnO、Al粉和C2Cl6,其发烟过程中的化学反应如下:
①3ZnO+2Al→Al2O3+3Zn
②3Zn+C2Cl6→3ZnCl2+2C
下列有关叙述不正确的是
A. 反应①是铝热反应
B. 反应②是置换反应
C. C2Cl6属于卤代烃
D. 氧化性:Al>Zn>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点FeO________NiO(填“<”或“>”);
②铁有δ、γ、α三种同素异形体,各晶胞如下图,则δ、α两种晶胞中铁原子的配位数之比为________。
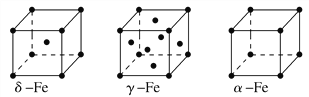
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的强相互作用是________。
(3)某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
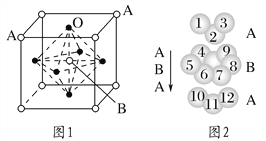
①用A、B、O表示这类特殊晶体的化学式:_________________________。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为________。
③下列有关说法正确的是________。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是
A. 电解饱和食盐水,产生黄绿色气体:2NaCl+2H2O==2NaOH+H2↑+Cl2↑
B. 用Na2CO3溶液将水垢中的CaSO4转化为CaCO3:CO32-+Ca2+==CaCO3↓
C. 向H2O2溶液中滴加CuSO4溶液,产生气泡:H2O2==H2O+O2↑
D. 向苯酚浊液中滴加Na2CO3溶液,溶液变澄清:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.元素的第一电离能越大,其金属性一定越强
B.元素的第一电离能越小,其金属性一定越强
C.同主族元素的单质从上到下,金属性增强,熔点升高
D.金属单质与酸反应越容易,其元素的电负性越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. HF、HCl、HBr、HI的熔、沸点依次升高
C. CO2、SO2都是极性分子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)金属冶炼和处理常涉及氧化还原反应。
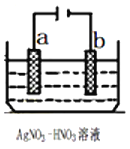
(1)如图为电解精炼银的示意图,__________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为___________。
(2)为处理银器表面的黑斑(Ag2S),可将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,该过程依据的是电化学中的_________原理(填“原电池”或“电解池”),食盐水的作用为________。
(二)FeCl3具有净水作用,但腐蚀设备,所以工业上常选用电浮选凝聚法处理污水.其原理是保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.某课外小组用电浮选凝聚法处理污水,设计如图所示装置示意图。
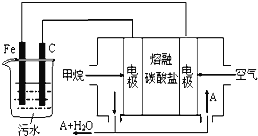
(3)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ_______________,Ⅱ_______________。
(4)该燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极,负极电极反应式为______________。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(如图),A物质的化学式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com