
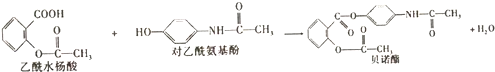
| A. | 根据有机物的分类,乙酰水杨酸也属于芳香烃 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| D. | 1mol乙酰水杨酸最多能与2molNaOH发生反应 |
分析 A.乙酰水杨酸含有O元素,而烃只含C、H元素;
B.对乙酰氨基酚含酚-OH;
C.乙酰水杨酸含-COOH,酚-OH不能能与NaHCO3溶液反应;
D.乙酰水杨酸含有羧基、酯基,且酯基可水解生成酚羟基.
解答 解:A.乙酰水杨酸含有O元素,而烃只含C、H元素,乙酰水杨酸属于烃的衍生物,故A错误;
B.对乙酰氨基酚含酚-OH,遇FeCl3溶液显紫色,则可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚,故B正确;
C.乙酰水杨酸含-COOH,酚-OH不能与NaHCO3溶液反应,故C错误;
D.乙酰水杨酸含有羧基、酯基,且酯基可水解生成酚羟基,则1mol乙酰水杨酸最多能与3molNaOH发生反应,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,明确酚及酯的性质是解答本题的关键,注意选项C中的酚的酸性为解答的难点和易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,2LpH=12的氨水中含有OH-数目为0.02NA | |
| B. | 氯碱工业中,外电路中转移电子数为0.3NA时产生气体体积(标准状况)为4.48L | |
| C. | 标准状况下,11.2LCH3Cl中非极性共价键数目等于2.0NA | |
| D. | 一定条件下,1molI2和0.2molH2混合充分反应,转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化学实验中需要用温度计的有石油分馏、硝基苯的制备和乙烯的制取 | |
| B. | 用溴水可以鉴别苯酚溶液、甲苯、乙醇和苯乙烯 | |
| C. | 用酒精可以处理粘在皮肤上的苯酚或苯酚醛树脂制备实验后的试管 | |
| D. | 取适量卤代烃水解后产物,直接滴加AgNO3溶液以确定卤原子种类 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1molN2和3molH2混合,充分反应后转移的电子数为NA | |
| B. | 1.5molNO2与足量水反应,转移的电子数为1.5NA | |
| C. | 6.4g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| D. | 常温常压下,11.2LCl2含氯原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移的电子数为3NA | |
| B. | 标准状况下,0.5 NA 个NO和0.5 NA 个O2混合气体的体积约为22.4 L | |
| C. | 一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目为2NA | |
| D. | 在电解CuSO4溶液的实验中,测得电解后溶液pH=0,又知电解后溶液体积为1 L,在阳极析出的气体分子数约为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
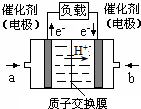 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法中正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法中正确的是( )| A. | 右边的电极为电池的负极,b处通入的是空气 | |
| B. | 左边的电极为电池的负极,a处通入的是甲醇 | |
| C. | 电池负极的反应式为:CH3OH+H2O═CO2+6H++4e- | |
| D. | 电池正极的反应式为:O2+2H2O+4e-═4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com