
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数多 | |
| C. | 5.2g 26Al3+中所含的电子数约为6.02×1024 | |
| D. | 26Al和26Mg的质子数和核外电子数均不相同,中子数相同 |
分析 A.10Be和9Be互为同位素;
B.10Be的原子核内质子数为4,中子数为10-4=6;
C.结合n=$\frac{m}{M}$、N=nNA计算;
D.26Al和26Mg的质子数分别为13、12,中子数分别为13、14,质子数等于核外电子数.
解答 解:A.10Be和9Be互为同位素,中子数不同,质子数相同,故A正确;
B.10Be的原子核内质子数为4,中子数为10-4=6,中子数比质子数多,故B正确;
C.5.2g 26Al3+中所含的电子数约为$\frac{5.2g}{26g/mol}$×(13-3)×NA≈1.2×1024,故C正确;
D.26Al和26Mg的质子数分别为13、12,中子数分别为13、14,质子数等于核外电子数,所以质子数、中子数和核外电子数都不相同,故D错误;
故选D.
点评 本题考查物质的量的计算及原子中的数量关系,侧重分析能力及计算能力、知识迁移应用能力的考查,注重基础知识的夯实,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 用湿润的pH试纸测溶液的pH,测定值一定有误差 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测中和热的值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤①②④③ | B. | ⑤①②④③ | C. | ⑤②①④③ | D. | ④①⑤②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
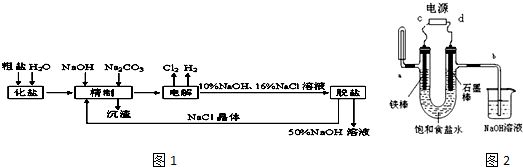
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2的消耗速率与NO的生成速率相等 | |
| B. | 容器内压强不随时间变化而变化 | |
| C. | NO2和O2的消耗速率之比为1:1 | |
| D. | 单位时间内生成2n mol NO.同时生成n mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
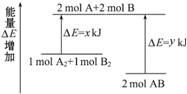
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | 葡萄糖的燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 | |
| D. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | mol/L•s | B. | mol•(L•min)-1 | C. | mol/(L•min) | D. | mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com