
分析 要解这类题目,关键是理解好有关概念.氢氧化钠固体、氯化氢气体、碳酸钠粉末、CuSO4•5H2O晶体不能导电,但它们溶于水或熔融状态下可导电,属于电解质;铜丝、稀硫酸,氨水、熔融氯化钠可以导电,但铜是单质、氨水是混合物,它们既不是电解质,也不是非电解质;二氧化碳气体和蔗糖熔化状态下不能导电,溶于水时蔗糖溶液也不导电,所以蔗糖是非电解质,二氧化碳的水溶液虽然能导电,但由于在溶液中发生电离的是二氧化碳与水反应生成的碳酸,二氧化碳并未发生电离,故二氧化碳是非电解质.
解答 解:①能导电的物质有金属、电解质溶液或熔融液,即含有自由移动离子的物质.符合条件的有②④⑥⑨,故答案为:②④⑥⑨;
②电解质是在水溶液或熔融状态下能导电的化合物,符合条件的有①③⑦⑨⑩,故答案为:①③⑦⑨⑩;
③非电解质是在水溶液和熔融状态下均不能导电的化合物,符合条件的有⑤⑧,故答案为:⑤⑧;
④电解质若未电离出自由移动的离子也不会导电,符合条件的有①③⑦⑩,故答案为:①③⑦⑩.
点评 本题主要考查了电解质与非电解质的概念问题,注意电解质和导电性的关系,导电的不一定是电解质,电解质不是任何条件下都导电,题目难度不大.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,氧化剂经化学变化变成还原产物 | |
| B. | 在氧化还原反应中,氧化剂被氧化,还原剂被还原 | |
| C. | 在化学反应中,能把其他物质氧化的物质是氧化剂 | |
| D. | 氧化还原反应的本质是电子得失或电子对的偏移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物 质 | 选用试剂(过量) | 操作方法 | |
| A | CaO(CaCO3) | 水 | 过滤 |
| B | CuO(Fe) | 稀盐酸 | 加入稀盐酸充分反应后过滤 |
| C | CuSO4溶液(H2SO4) | 氧化铜 | 加入氧化铜粉末充分反应后过滤 |
| D | 盐酸(H2SO4) | 硝酸钡溶液 | 加入硝酸钡溶液充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量就是物质的质量 | |
| B. | 摩尔是国际单位制中七个基本物理量之一 | |
| C. | 物质的量是量度物质所含微粒多少的一个物理量 | |
| D. | 1mol任何物质都含有6.02×1023个微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、SO42-、NO3- | B. | Na+、K+、SO42-、Cu2+ | ||
| C. | Ca2+、K+、Cl-、CO32- | D. | Mg2+、Fe3+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中逐渐通入CO2气体,先出现白色沉淀,继续通入CO2气体,白色沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液. |
| B | 某无色晶体加入NaOH浓溶液中并加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| C | 用蒸馏法能将溶解在CCl4中的碘单质分离出来 | 因为碘易升华,故蒸馏时先分离出来 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2>F e3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
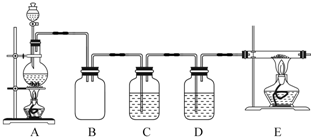
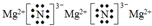 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com