
【题目】下列表示溶液中发生反应的化学方程式错误的是
A. 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
B. KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O
C. MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D. K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
【答案】B
【解析】
A项,Al与NaOH溶液反应生成NaAlO2和H2,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,A项正确;
B项,在碱性条件下,不可能产生CO2气体,而应是CO32-,反应的化学方程式应为2KMnO4+HCOOK+3KOH=2K2MnO4+K2CO3+2H2O,B项错误;
C项,MnO2与浓盐酸共热生成MnCl2、Cl2和H2O,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,C项正确;
MnCl2+Cl2↑+2H2O,C项正确;
D项,Fe2+具有还原性,能将Cr2O72-还原成Cr3+,自身被氧化成Fe3+,化学方程式正确,D项正确;
答案选B。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
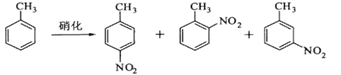
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是________________________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于______层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_______________。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是___________________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )
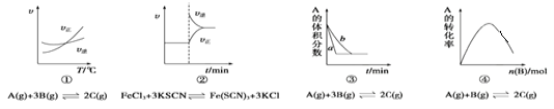
A.①是其他条件一定时,反应速率随温度变化的图像,则逆反应ΔH>0
B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率变化的图象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料, 原料的综合利用率较高。其主要流程如下:
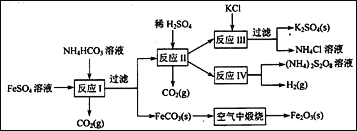
(1)反应I前需在FeSO4溶液中加入_____(填字母),以除去溶液中的Fe3+。
A.锌粉 | B.铁屑 | C.KI溶液 | D.H2 |
(2)反应I需控制反应温度低35℃,其目的是______________________。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是:________。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极
发生的电极反应可表示为:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:

(1)写出生成A的化学方程式__________________;
(2)写出苯和液溴反应生成E的化学方程式________;其反应类型为____________。
(3)C的结构简式为___________;由B生成C的反应类型为____________。
(4)乳酸(![]() )生成六元环酯的化学方程式:__________
)生成六元环酯的化学方程式:__________
(5)乙酸苯酚酯(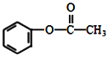 )在热的NaOH溶液中反应的化学方程式:__________
)在热的NaOH溶液中反应的化学方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向20 mL 0.1 mol/L HA溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是

A. 由题可知HA为弱酸
B. 滴定终点位于c和d之间
C. 滴定到b点时:n(Na+)+ n(H+)-n(OH-)+ n(HA)=0.002 mol
D. 滴定到d点时:c(OH-)>c(Na+)>c(A-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。 学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取mg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;发生反应:IO3﹣+5I﹣+6H+=3I2+3H2O,将反应后的溶液加水稀释至100.00 mL。
c.取10.00mL上述溶液到锥形瓶中,以淀粉为指示剂,用物质的量浓度为3.0molL﹣1的 Na2S2O3溶液滴定(滴定时的反应方程式:I2+2S2O32﹣═2I﹣+S4O62﹣)。
d.重复实验2次,三次实验分别记录有关数据如下:
滴定次数 | 待测溶液的体积/mL | 1.00×10﹣3molL﹣1的 Na2S2O3溶液的体积(mL) | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 10.00 | 2.62 | 22.60 |
第二次 | 10.00 | 7.56 | 30.30 |
第三次 | 10.00 | 6.22 | 26.24 |
试回答:
(1)如下图,是某次滴定时的滴定管中的液面,其读数为___________mL。
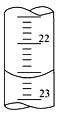
(2)判断到达滴定终点的现象是:_______________________。
(3)滴定时,Na2S2O3溶液应放在______________ (填“酸式滴定管”或“碱式滴定管”)。
(4)根据实验测定数据,计算加碘食盐样品中的碘元素百分含量是_______(以含m的代数式表示)。
(5)根据上述实验对下列假定情况进行讨论,导致测出待测液的浓度是(填“偏小”、“偏大”或“无影响”)
①标准液读数时,若滴定前俯视,滴定后仰视,测出待测液的浓度__________
②盛标准液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,测出待测液的浓度___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)![]() N2O4(g) △H <0,升高温度该反应平衡常数增大
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. CO2+H2 ![]() CO+H2O的平衡常数表达式为K==
CO+H2O的平衡常数表达式为K==![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com