
���� ��1����a������������ǿ�̼�����ζ���ж����壻
b��������̼���ŷŲ����γ����ꣻ
c�����������һ����̼��̼�⻯����ȷ�����ǿ�ҵ��չ������£���Щ�ŷ�����⻯��Ӧ�����ɶ�����Ⱦ�����һ��dz��ɫ���д̼��Ե�����Ϊ�⻯ѧ������
d����������̼���á�������ٻ�ʯȼ�ϵ�ʹ�ã����������Դ�����������������ȼú����������β�����������ɼ�����Ⱦ��������ŷţ�
�ڼ���һˮ�ϰ��Ͷ����������ʵ�������ϻ�ѧ����ʽ������ϵSO2+2NH3•H2O=��NH4��2SO3+H2O��SO2+NH3•H2O=NH4HSO3�������жϲ��
������ԭ��ظ�������������Ӧ��������������Ԫ�ػ��ϼ����ߣ�ʧȥ���ӷ���������Ӧ������������ԭ��Ӧ�����Ԫ�ػ��ϼ۱仯�����жϣ�
��2���䷴Ӧԭ��ΪSO2+Na2S+H2O=H2S+Na2SO3��2H2S+SO2=3S��+2H2O������3SO2+2Na2S=3S��+2Na2SO3��
��������Na2S2O3������ǿ�ᷴӦ������dz��ɫ�����������ԭ��ΪNa2S2O3+SO2+H2O=S��+2NaHSO3��
3SO2+2Na2S=3S��+2Na2SO3��
SO2+Na2CO3=Na2SO3+CO2��
Na2SO3+S=Na2S2O3��
��+��+�ۡ�3��4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2��
��� �⣺��1����a��SO2������Σ����Ҫ�Ǵ̼��˺ͺ��������۾�����������SO2Ũ�ȴ�һ���̶�ʱ��������ͼ��غ���ϵͳ����Ѫ�ܼ�������a��ȷ��
b��SO2��NOx�ŷ��γ����꣬������̼���ŷŲ����γ����꣬��b����
c�����������һ����̼��̼�⻯����ȷ�����ǿ�ҵ��չ������£���Щ�ŷ�����⻯��Ӧ�����ɶ�����Ⱦ�����һ��dz��ɫ���д̼��Ե�����Ϊ�⻯ѧ��������C��ȷ��
d����������̼���á�������ٻ�ʯȼ�ϵ�ʹ�ã����������Դ�����ٶԻ�ʯ��Դ�����������������������ȼú����������β�����������ɼ�����Ⱦ��������ŷţ�����߿�����������D��ȷ��
�ʴ�Ϊ��b��
������15L 2.0mol•L-1��ˮ�������4480L��10%��SO2����β�����������������ɱ�״������
n��NH3•H2O��=15L��2.0mol/L=30mol��n��SO2��=$\frac{4480L}{22.4L/mol}$��10%=20mol��
SO2+2NH3•H2O=��NH4��2SO3+H2O
SO2+NH3•H2O=NH4HSO3��
1��2��n��SO2����n��NH3•H2O��=20��30=2��3��1��1
��ַ�Ӧ������Һ�е�����Ϊ��NH4��2SO3��NH4HSO3��
�ʴ�Ϊ����NH4��2SO3��NH4HSO3��
��ԭ��ط�Ӧ�Ǹ�������������Ӧ������������ԭ��Ӧ������Ԫ�ػ��ϼ۱仯��֪��������������Ԫ�ػ��ϼ����ߣ�ʧȥ���ӷ���������Ӧ�������У���SO2ͨ���صĸ������缫��ӦΪ��SO2+2H2O-2e-=SO42-+4H+�������������õ�������ˮ����缫����Ϊ��O2+4H++4e-=2H2O��
�ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+��
��2���䷴Ӧԭ��ΪSO2+Na2S+H2O=H2S+Na2SO3��2H2S+SO2=3S��+2H2O������3SO2+2Na2S=3S��+2Na2SO3��
��������Na2S2O3������ǿ�ᷴӦ������dz��ɫ�����������ԭ��ΪNa2S2O3+SO2+H2O=S��+2NaHSO3��
3SO2+2Na2S=3S��+2Na2SO3��
SO2+Na2CO3=Na2SO3+CO2��
Na2SO3+S=Na2S2O3��
��+��+�ۡ�3��4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2��
����Na2S��Na2CO3�����ʵ���֮��Ϊ2��1��
�ʴ�Ϊ��2H2S+SO2=3S��+2H2O��2��1��
���� ���⿼���Ϊ�ۺϣ��漰�����Ʊ�ʵ�鷽����ԭ���ԭ���ķ����жϣ����ؿ����������ʣ���ѧ����ʽ��д�����������жϷ�Ӧ����ķ�����Ӧ�ã���Ŀ����������ѧ�����õĿ�ѧ��������Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
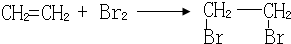 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
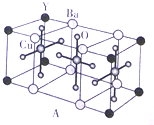 NH3��Ϊ�����ᣬ������Ϊ��ɫ�д̼�����ζ��Һ�壬N${\;}_{3}^{-}$Ҳ����Ϊ��±���ӣ�������������Ʒ�Ӧ���Ƶõ����ᣬ���������ƿɴ����з�Ӧ�Ƶã�NaNH2+N2O�TNaN3+H2O��HN3��Ũ������Һ���ܽ�ͭ��������Ȳ����ý������ܽ�ͭ����CuCl${\;}_{2}^{-}$��ͭ�Ͳ��Ļ������ڳ�����ҽҩ������ҪӦ�ã�Cu�Ļ�����A��������ͼ��ͼ��С���������ԭ�ӣ��������ΪY��Cu��Baԭ�ӣ���Ϊ����������֮һ������ѧʽΪPt��NH3��2Cl2�Ļ������������칹�壬����B�칹����п����ԣ����������ư�֢���Իش��������⣺
NH3��Ϊ�����ᣬ������Ϊ��ɫ�д̼�����ζ��Һ�壬N${\;}_{3}^{-}$Ҳ����Ϊ��±���ӣ�������������Ʒ�Ӧ���Ƶõ����ᣬ���������ƿɴ����з�Ӧ�Ƶã�NaNH2+N2O�TNaN3+H2O��HN3��Ũ������Һ���ܽ�ͭ��������Ȳ����ý������ܽ�ͭ����CuCl${\;}_{2}^{-}$��ͭ�Ͳ��Ļ������ڳ�����ҽҩ������ҪӦ�ã�Cu�Ļ�����A��������ͼ��ͼ��С���������ԭ�ӣ��������ΪY��Cu��Baԭ�ӣ���Ϊ����������֮һ������ѧʽΪPt��NH3��2Cl2�Ļ������������칹�壬����B�칹����п����ԣ����������ư�֢���Իش��������⣺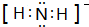 ������ԭ�ӵ��ӻ�������sp3
������ԭ�ӵ��ӻ�������sp3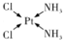 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������һ�����õĵ��ȡ�������� | |
| B�� | Ԫ�صķǽ�����Խǿ�����⻯��ķе�Խ�� | |
| C�� | ͬ������������Ԫ�ص�ԭ�ӣ���������֮���Ϊ1 | |
| D�� | ����������Ϊ4��ԭ�ӣ���Ԫ��һ�����ڢ�A�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���е��������ӿ��ȼ���������ˮ���ٹ��˶���ȥ | |
| B�� | �����Ӿ����������ˮ�У�����ʱȫ���ܽ⣬��ȴ���γ�����Һ | |
| C�� | ���ӵ����Ժ���������ʹ���ָʾ����ɫ | |
| D�� | �����ж�������ϡ��Һ��ֱ�������������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����2��ԭ����ɵķ�����HF����������OH-��
����2��ԭ����ɵķ�����HF����������OH-���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢ۢ� | C�� | �ڢۢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com