

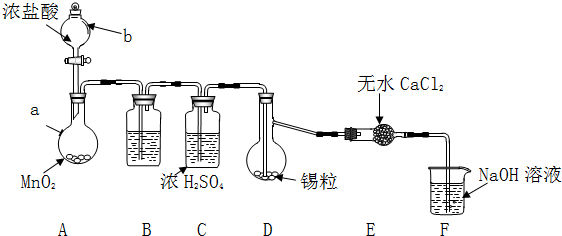
分析 (1)高锰酸钾与浓盐酸反应生成氯化锰、氯化钾、氯气与水;
(2)氯气中混有挥发出的HCl,会影响产品中NaClO含量,用盛有饱和氯化钠溶液的洗气瓶除去HCl;
(3)水合肼有强还原性,NaClO具有强氧化性,如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;NaClO过量会氧化水合肼生成氮气、氯化钠水;
(4)由题目信息,水合肼能腐蚀橡胶玻璃等,玻璃塞属于硅酸盐,也可以腐蚀陶瓷,应选择铁质容器;
(5)水合肼为液态,与水互溶,沸点相差较大,应擦去分馏方法进行分离;需要用冷凝水冷凝蒸出的馏分,需要温度计控制收集118℃的馏分.
解答 解:(1)高锰酸钾与浓盐酸反应生成氯化锰、氯化钾、氯气与水,反应离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)氯气中混有挥发出的HCl,与氢氧化钠反应生成NaCl,会影响产品中NaClO含量,添加一个用盛有饱和氯化钠溶液的洗气瓶除去HCl,
故答案为:没有除去氯气中混有的HCl,影响产品中NaClO含量;加一个用盛有饱和氯化钠溶液的洗气瓶;
(3)水合肼有强还原性,NaClO具有强氧化性,如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化,故分液漏斗中的溶液是NaClO碱性溶液,b中应装尿素;
NaClO过量会氧化水合肼生成氮气、氯化钠水,反应方程式为:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl,
故答案为:NaClO碱性溶液;尿素;N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;
(4)由题目信息,水合肼能腐蚀橡胶玻璃等,玻璃塞属于硅酸盐,也可以腐蚀陶瓷,应选择铁质容器,
故选:C;
(5)水合肼为液态,与水互溶,沸点相差较大,应擦去分馏方法进行分离;需要用冷凝水冷凝蒸出的馏分,需要温度计控制收集118℃的馏分,
故答案为:蒸馏;冷凝管、温度计.
点评 本题考查物质制备实验,涉及氯气制备、对装置与操作的分析评价、物质分离提纯等,关键是对题目信息的理解应用,题目难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| Sn | 231 | 227 | 加热时与Cl2反应生成SnCl4 |
| SnCl2 | 246 | 652 | Sn2+易被Fe3+、O2等氧化 |
| SnCl4 | -33 | 114 | 极易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出1780kJ的能量 | B. | 放出1220kJ的能量 | ||
| C. | 放出450kJ的能量 | D. | 吸收430kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法不正确的是( )
如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法不正确的是( )| A. | 此电池的能量转化率未达到100% | |
| B. | 铝罐将逐渐被腐蚀,电池供电时铝罐上发生氧化反应 | |
| C. | 炭棒应与玩具电机的正极相连 | |
| D. | 电池工作一段时间后炭棒和碳粒的质量会减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W重新沉积到灯丝上 | |
| B. | 灯丝附近温度越高,WI2(g)的转化率越低 | |
| C. | 该反应的平衡常数表达式是K=$\frac{c(W)•c({I}_{2})}{c(W{I}_{2})}$ | |
| D. | 灯内温度升高时,压强不会变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑥ | B. | ②⑥ | C. | ①②③④⑤⑥ | D. | ①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com