
������ط�Ӧ�����ӷ���ʽ��д��ȷ����
A������������������Fe(OH)3 +3H+ ��Fe3++3H2O
B������0.4mol FeBr2����Һ��ͨ��0.1mol Cl2��Ӧ��2Fe2++Cl2��2Fe3+ +2Cl��
C��NH4Al(SO4)2��Һ�м���Ba(OH)2��ҺʹSO42����ȫ������Al3+��2SO42����2Ba2+��4OH����AlO2����2BaSO4����2H2O
D��NaHCO3��Һ�м��������Ba(OH)2��Һ��2HCO3��+Ba2++2OH�� = BaCO3? +2H2O+CO32��
B
��������
���������A��������������������ɵ������Ӿ���ǿ�����ԣ���������ӷ���������ԭ��Ӧ���ɵ⣬����B���������ӵ������Ե�ǿ����������������������Ӧ���������ӵ����ʵ��������������ʵ���֮����0.4:0.1=4:1��������������������ȫ��Ӧʱ�����ʵ���֮����2:1�������������ӹ�����������ֻ���������ӷ�Ӧ�����Ȼ�������ȷ��C��NH4Al(SO4)2��Һ�м���Ba(OH)2��ҺʹSO42����ȫ����ʱNH4Al(SO4)2���ʵ�����Ba(OH)2���ʵ���֮����1:2����ʱ�����������������ӷ�Ӧ��������������������笠����ӷ�Ӧ����һˮ�ϰ�����������ƫ��������ӣ�����D��NaHCO3��Һ�м��������Ba(OH)2��Һ������NaHCO3=Na++HCO3-���ж�1��̼���������ֻ����1�����������ӷ�Ӧ����1��̼������Ӻ�ˮ�����뱵���ӽ��Ϊ̼�ᱵ���������������ӷ���ʽ����������ѡB��
���㣺�������ӷ���ʽ��д���ж�


 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�����ʡ����10���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ�㶨�������г���2 mol X��1 mol Y������Ӧ��2X(g)��Y(g) nZ(g)�ﵽƽ���Z���������Ϊa%����ά���������ݻ����¶Ȳ��䣬����ʼ���ʵ���XΪ0.6 mol��YΪ0.3 mol��ZΪ1.4 mol���������У��ﵽƽ���Z�����������Ϊa%����n��ֵΪ( )
nZ(g)�ﵽƽ���Z���������Ϊa%����ά���������ݻ����¶Ȳ��䣬����ʼ���ʵ���XΪ0.6 mol��YΪ0.3 mol��ZΪ1.4 mol���������У��ﵽƽ���Z�����������Ϊa%����n��ֵΪ( )
A������Ϊ2��Ҳ����Ϊ3 B��ֻ��Ϊ3
C��ֻ��Ϊ2 D����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�������Һ�У��й��������ʵ���Ũ�ȹ�ϵ��ȷ����
A��0.1 mol��L��1 (NH4)2Fe(SO4)2��Һ�� c(NH )> c(SO
)> c(SO )>c(Fe2��)>c(H��)
)>c(Fe2��)>c(H��)
B��0.1 mol��L��1 Na2CO3��Һ��c(Na��)��c(H��)��c(CO )��c(HCO
)��c(HCO )��c(OH��)
)��c(OH��)
C��0.1 mol��L��1 NaHCO3��Һ��c(H��)��2c(H2CO3)��c(OH��)��c(CO )
)
D��0.01 mol��L��1NaOH��Һ������pH=2�Ĵ����Ϻ����Һ�У�
c (CH3COO��) > c (Na+) > c (H+)> c (OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������һ����Ͽ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��1 L��Һ�к���Fe(NO3)3��H2SO4�������ʣ���Ũ�ȷֱ�Ϊ0.2 mol?L-1��1.5 mol?L-1���������Һ�м���39.2 g����ʹ���ַ�Ӧ�������й�˵����ȷ����
A����Ӧ����Һ��Fe3+���ʵ���Ϊ0.8 mol
B����Ӧ�����13.44 L H2����״����
C����Ӧ����Һ��Fe2����Fe3�����ʵ���֮��Ϊ0.9 mol
D������������Fe3+>H+���ʷ�Ӧ����û������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������һ����Ͽ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������Ӽ������ۼ��ĸ�����������ȷ����
A�������ӻ������ֻ�������Ӽ���û�й��ۼ�
B���Ǽ��Լ�ֻ������˫ԭ�ӵĵ��ʷ���(��Cl2)��
C���ڹ��ۻ���������У�һ�����������Ӽ�
D���ɲ�ͬԪ����ɵĶ�ԭ�ӷ����һ��ֻ���ڼ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������һ����Ͽ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й��ڡ����ʵ���������Ħ�����͡�Ħ������������������ȷ����
A�����ʵ�Ħ��������������Է��ӣ�ԭ�ӣ�����
B�������ʵ������ǹ��ʵ�λ���е�һ��������λ
C��0.012 kg 12C��������̼ԭ����ΪNA
D��1mol�κ����ʶ�����Լ6.02��1023��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��ˮ�и�һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������20mL��0��5mol/L�� KMnO4��Һ�ɽ�25mL��2mol/L��FeSO4��Һ�е� Fe2+����ΪFe3+����KMnO4����ԭ�IJ�����
A��Mn2O3 B��Mn2+ C��MnO2 D��K2MnO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��ˮ�и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
��20�֣��ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe��ˮ�����ɷ�����Ӧ�� Ӧ������װ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ����¡�Fe��ˮ�����ķ�Ӧʵ�顱��
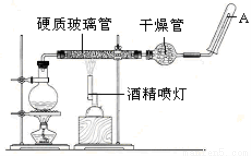
��ش��ʵ���е����⡣
��1��д���÷�Ӧ�ķ�Ӧ����ʽ�� ����ָ����������ԭ��Ӧ�Ļ�ԭ���� ���������� ��
��2��ʵ��ǰ���������װ�ý��������Լ�飬���������� ��
��3��Բ����ƿ��ʢװ��ˮ����װ�����Ⱥ����Ҫ������ ����ƿ�ײ������˼�Ƭ���Ƭ�����Ƭ�������� ��
��4���������ʢװ�ǵ������� �������� ��
��5���Թ����ռ������� �����Ҫ��A�������ܴ���ȼ�����壬�����Ը�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��ˮ�и߶���ѧ�����п��Ի�ѧ�������Ծ��������棩 ���ͣ�ѡ����
���ᣨH2C2O4���Ƕ�Ԫ���ᣬ����������Һ�����ԡ���������10mL 0.01mol/L NaHC2O4��Һ�еμ�0.01mol/L NaOH��Һ������NaOH��Һ��������ӣ���Һ������Ũ�ȹ�ϵ��ȷ����
A��V(NaOH) = 0ʱ��c(H+)=1��10��2mol/L
B��V(NaOH) <10mLʱ��һ������c(Na+)��c(C2O42-)��c(HC2O4�� -)
C��V(NaOH) = 10 mLʱ��c(H+) = 1��10��7 mol/L
D��V(NaOH)��10 mLʱ��c(Na+)��c(C2O42-)��c(HC2O4-)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com