
【题目】以下是由甲苯为起始原料的一系列变化,请填写下列空白: 
(1)写出化合物B的结构简式: .
(2)由B到C的反应类型是 .
(3)任意写出两种同时符合下列要求的化合物C的同分异构体的结构简式(E、F、G除外) .
①化合物是1,4﹣二取代苯,其中苯环上的一个取代基是硝基;
②分子中含有﹣COO﹣结构的基团.
(4)E,F,G中有一种化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,这种化合物是(在E,F,G中选择,填字母).
(5)一定条件下,化合物D发生聚合反应的化学方程式是: .
【答案】
(1)![]()
(2)酯化反应
(3)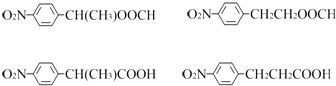 任意2种
任意2种
(4)F
(5)![]()
【解析】解:由C的还原产物结构可知,甲苯与浓硝酸在浓硫酸、加热条件下发生对位取代反应生成A,则A为 ![]() ,A中甲基被氧化为﹣COOH生成B,则B为
,A中甲基被氧化为﹣COOH生成B,则B为 ![]() ,B与乙醇发生酯化反应生成C,则C为
,B与乙醇发生酯化反应生成C,则C为 ![]() ,硝基被还原为氨基生成
,硝基被还原为氨基生成 ![]() ,最后发生水解反应生成D与乙醇,则D为
,最后发生水解反应生成D与乙醇,则D为 ![]() .
.
(1.)由上分析可知,化合物B的结构简式为: ![]() ,
,
所以答案是: ![]() ;
;
(2.)由B到C是 ![]() 与乙醇发生酯化反应生成
与乙醇发生酯化反应生成 ![]() ,所以答案是:酯化反应;
,所以答案是:酯化反应;
(3.)化合物 ![]() 的同分异构体同时符合下列要求:
的同分异构体同时符合下列要求:
①化合物是1,4﹣二取代苯,其中苯环上的一个取代基是硝基,
②分子中含有﹣COO﹣结构的基团,符合条件的同分异构体的结构简式(E、F、G除外)有: 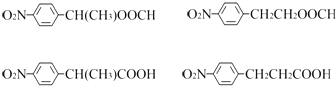 ,
,
所以答案是: 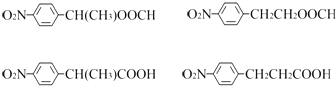 任写2种;
任写2种;
(4.)E、F、G中有一种化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,含有羧酸与酚羟基形成的酯基,故种化合物F符合,所以答案是:F;
(5.)一定条件下,化合物 ![]() 发生聚合反应的化学方程式是:
发生聚合反应的化学方程式是: ![]() ,
,
所以答案是: ![]() .
.


科目:高中化学 来源: 题型:
【题目】欲配制100mL 0.1mol/L Na2SO4溶液,正确的方法是( ) ①将32.2g Na2SO4 . 10H2O溶于少量水中,再加水稀释至100mL
②将14.2g Na2SO4溶于100mL水中
③将20mL 0.5mol/L Na2SO4溶液用水稀释至100mL.
A.①②
B.②③
C.①③
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究温度对某种酶活性的影响,设置三个实验组:A组(20℃)、B组(40℃)和C组(60℃),测定各组在不同反应时间内的产物浓度(其他条件相同),结果如图。回答下列问题:

(1)三个温度条件下,该酶活性最高的是 ________组。
(2)在时间t1之前,如果A组温度提高10℃,那么A组酶催化反应的速度会 ____________。
(3)如果在时间t2时,向C组反应体系中增加2倍量的底物,其他条件保持不变,那么在t3时,C组产物总量____________,原因是________________________________ 。
(4)生物体内酶的化学本质是_________________,其特性有___________________,_______________________答出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.将标准状况下11.2L HCl溶于水,配成250mL盐酸,溶液的物质的量浓度为2mol/L
B.硫酸和磷酸的摩尔质量相等
C.同温同压下,相同质量的二氧化碳和二氧化硫的体积比是16:11
D.2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)[探究一]将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+ . 若要确认其中的Fe2+ , 应选用(选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为
(3)[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体.为此设计了下列探究实验装置(图中夹持仪器省略). 
装置B中试剂的作用是 .
(4)认为气体Y中还含有Q的理由是(用化学方程式表示).
(5)为确认Q的存在,需在装置中添加M于(选填序号).
a.A之前 b.A﹣B间 c.B﹣C间 d.C﹣D间
(6)如果气体Y中含有H2 , 预计实验现象应是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)[探究一]将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+ . 若要确认其中的Fe2+ , 应选用(选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为
(3)[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体.为此设计了下列探究实验装置(图中夹持仪器省略). 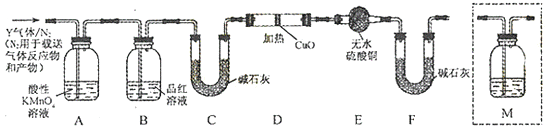
装置B中试剂的作用是 .
(4)认为气体Y中还含有Q的理由是(用化学方程式表示).
(5)为确认Q的存在,需在装置中添加M于(选填序号).
a.A之前 b.A﹣B间 c.B﹣C间 d.C﹣D间
(6)如果气体Y中含有H2 , 预计实验现象应是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3 , 溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w= ![]() ×100%
×100%
②c= ![]()
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w.
A.①③
B.②③
C.①②
D.只有②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下各实验:
A.将1 g KCl加入10 g沸腾的水中;
B.将1 g可溶性淀粉加入到100 g水中,搅拌均匀后煮沸;
C.将1 g CaCO3粉末加入100 g水中,充分振荡;
D.将0.1 g植物油加入到10 g水中,充分振荡混匀;
E.将96 mL乙酸与5 mL水充分混合.
上述实验中所得到的分散系,属于溶液的有______,属于胶体的是________,属于浊液的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com