
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):分析 (1)图象分析可知先拐先平,温度高,甲醇物质的量减小,说明升温平衡逆向进行,正反应为放热反应,根据温度对平衡的影响,判断K的变化;
(2)根据图中甲醇的变化量,求出氢气的变化量,再根据v(H2)=$\frac{△c}{△t}$计算;
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的$\frac{1}{2}$,则压强增大,正逆反应速率都增大,平衡向正向移动,甲醇的物质的量增多,氢气的物质的量减小,但由于体积减小,平衡时氢气的浓度反而增大,根据浓度比值等于物质的量比值.
解答 解:(1)500℃时甲醇的物质的量小,所以升高温度,平衡逆移,所以K减小,
故答案为:减小;
(2)在500℃,平衡时图中甲醇的变化量为nB,所以反应消耗的氢气的量为:2nB,则v(H2)=$\frac{△c}{△t}$=$\frac{2{n}_{B}}{3{t}_{B}}$,
故答案为:$\frac{2{n}_{B}}{3{t}_{B}}$;
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的$\frac{1}{2}$,则压强增大,正逆反应速率都增大,平衡向正向移动,甲醇的物质的量增多,氢气的物质的量减小,但由于体积减小,平衡时氢气的浓度反而增大,根据浓度比值等于物质的量比值,则有重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小,即bc正确,
故答案为:b c.
点评 本题考查化学平衡移动及其计算,题目难度中等,本题注意外界条件对平衡移动的影响.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 表示.下列说法不正确的是( )
表示.下列说法不正确的是( )| A. | X属于烃 | |
| B. | X能使酸性高锰酸钾溶液褪色 | |
| C. | X与 互为同分异构体 互为同分异构体 | |
| D. | X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,用惰性电极电解某浓度的NaOH溶液,一小段时间后,NaOH溶液的浓度可能增大,也可能不变 | |
| B. | 实验室里需要480 mL 2.0 mol/L的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、定容、摇匀等步骤进行操作 | |
| C. | 配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水 | |
| D. | 实验室配制500 mL 0.2 mol/L的硫酸亚铁溶液,其操作是:用天平称27.8 g绿矾,放入500 mL容量瓶,加水溶解、稀释、定容、摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
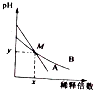 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )| A. | 稀释前,c(A)=10c(B) | |
| B. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 | |
| C. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L | |
| D. | 由图可知,A为强碱,B为弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 | |
| B. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 过氧化钠是强氧化剂,能氧化二氧化碳,因此过氧化钠可作呼吸面具中的供氧剂 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加100mL水将溶液稀释 | |
| B. | 向溶液中加入0.2molNaOH固体,并使之完全溶解 | |
| C. | 将溶剂蒸发掉一半 | |
| D. | 将原溶液浓缩至50mL(无NaOH析出) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com