
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01kJ•mol-1 |
| 反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,Ⅰ×2+Ⅱ+Ⅲ得到热化学方程式和对应焓变;
(2)反应是气体体积减小的放热反应,达到平衡状态的标志是正逆反应速率相同,各组分含量保持不变,分析选项中“变量不变”说明反应达到平衡状态;
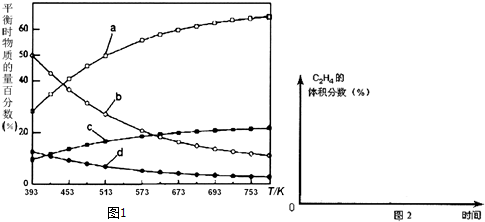
(3)正反应放热反应,由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线;
(4)反应是放热反应,降低温度,平衡正向进行,反应前后气体体积减小,可采取的措施是增大压强平衡正向进行,分离出生成物,平衡正向进行等措施,改变条件使平衡状态正向进行;
(5)393K时体系中C2H4的体积分数随反应时间的变化趋势是,常温进料开始计时,反应不能进行,随温度升高,反应开始进行到393达到平衡状态,随温度升高,平衡逆向进行乙烯含量减小,据此画出图象变化.
解答 解:(1)反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.01 kJ•mol-1
反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24.52 kJ•mol-1
反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g)△H3=-5.46 kJ•mol-1
依据盖斯定律计算Ⅰ×2+Ⅱ+Ⅲ得到:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H4=-128KJ/mol,
故答案为:-128;
(2)2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H4=-128KJ/mol,可以判断该反应已经达到平衡的是
A.v(CO2)=2v(C2H4)表示的是正反应速率之比,不能说明正逆反应速率相同,故A错误;
B.反应前后气体质量和体积不变,混合气体的密度始终不改变,不能说明反应达到平衡状态,故B错误;
C.反应前后气体物质的量变化,当混合气体的压强不再改变,说明反应达到平衡状态,故C正确;
D.平衡常数随温度变化,平衡常数K不再改变不能说明反应达到平衡状态,故D错误;
E.C2H4的体积分数不再改变是平衡的标志,故E正确;
故答案为:CE;
(3)正反应放热反应,由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线,
故答案为:H2;由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线;
(4)为提高CO2的平衡转化率,反应是放热反应,降低温度,平衡正向进行,反应前后气体体积减小,可采取的措施是增大压强或提高$\frac{n(H{\;}_{2})}{n(CO{\;}_{2})}$比值,分离出生成物,平衡正向进行,二氧化碳转化率增大,催化剂改变化学反应速率不改变化学平衡;
故答案为:ABD;
(5)常温进料开始计时,反应不能进行,随温度升高,反应开始进行到393达到平衡状态,随温度升高,平衡逆向进行乙烯含量减小,据此画出图象变化,393K时体系中C2H4的体积分数随反应时间的变化趋势是增大后不变,图象为: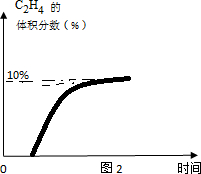 ,
,
故答案为:
点评 本题考查了热化学方程式书写方法,化学平衡影响因素,平衡标志分析,平衡常数,反应速率概念计算应用,图象的分析判断是解题关键,题目难度较大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:解答题
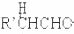 $\stackrel{稀碱}{→}$
$\stackrel{稀碱}{→}$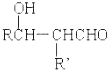
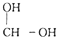 -OH$\stackrel{-H_{2}O}{→}$RCHO
-OH$\stackrel{-H_{2}O}{→}$RCHO .
. .
.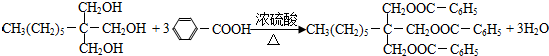 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
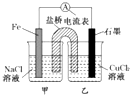
| A. | 原电池的总反应为 Fe+Cu2+=Fe2++Cu | |
| B. | 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2 mol电子 | |
| C. | 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑ | |
| D. | 盐桥中是KNO3溶液,则盐桥中NO3-移向乙烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
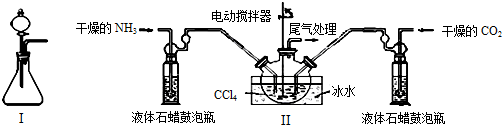
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200 g 63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,46 g乙醇中含有的共价键总数为8 NA | |
| B. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| C. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA | |
| D. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电负性较大的元素在化合物中只能形成负价,不能形成正价 | |
| B. | 若元素X的第一电离能比元素Y的第一电离能小,则X的金属活动性不一定强于Y | |
| C. | H元素与F元素的电负性差值达1.9,所以HF属于离子化合物 | |
| D. | 某元素原子外围电子排布式为3d64s2,则此元素可能易显+2和+3价,且+3价稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
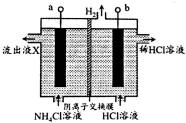 NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )
NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )| A. | b电极接电源的负极 | |
| B. | 阳极区被氧化的元素为Cl | |
| C. | 流出液X中不含HCl | |
| D. | 每生成3molH2,有6molCl-通过阴离子交换膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com