
| 选项 | 实验内容 | 实验目的 |
| A | 在碘水中加入约1mL四氯化碳,振荡试管,观察碘被四氯化碳萃取,再向试管里加入1mL浓KI水溶液,振荡试管,溶液紫色变浅 | 证明物质的溶解性规律--“相似相溶” |
| B | 取两只试管,分别加入4mL0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/LH2C2O4溶液2mL,向另一只试管中加入0.1mol/LH2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| C | 分别向2mL甲苯、2mL苯、2mL正己烷中加入3滴酸性高锰酸钾溶液,振荡.甲苯中酸性高锰酸钾溶液褪色,而苯、正己烷中酸性高锰酸钾溶液不褪色 | 证明与苯环相连的甲基易被氧化 |
| D | 将反应产生的气体依次通入盛有NaOH溶液、品红溶液及酸性KMnO4溶液的试管,品红不褪色,酸性KMnO4溶液褪色 | 证明乙醇与浓硫酸混合加热可得乙烯 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.在碘水溶液中加入约1mL四氯化碳(CCl4),振荡试管,观察碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液,再向试管里加入1mL浓碘化钾(I)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:I2+I-=I3-;
B.加入不同体积的草酸,溶液体积不同,高锰酸钾和草酸溶液的浓度都不同;
C.正己烷和苯不与酸性高锰酸钾溶液反应,甲苯和酸性高锰酸钾溶液反应;
D.二氧化碳和二氧化硫都能和NaOH反应而除去,二氧化硫能使品红溶液褪色,酸性高锰酸钾溶液能氧化乙烯而褪色.
解答 解:A.在碘水溶液中加入约1mL四氯化碳(CCl4),振荡试管,观察碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液,再向试管里加入1mL浓碘化钾(I)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:I2+I-=I3-,实验表明碘在纯水的溶解度小于四氯化碳中溶解度,所以能实现实验目的,故A不选;
B.加入不同体积的草酸,溶液体积不同,高锰酸钾和草酸溶液的浓度都不同,比较草酸的浓度对反应速率的影响,高锰酸钾的浓度应相同,所以不能实现实验目的,故B选;
C.甲苯可与酸性高锰酸钾反应生成苯甲酸,而苯、正己烷不反应,说明与苯环相连的甲基易被氧化,故C不选;
D.二氧化碳和二氧化硫都能和NaOH反应而除去,二氧化硫能使品红溶液褪色,所以用品红检验二氧化硫,酸性高锰酸钾溶液能氧化乙烯而褪色来检验乙烯,品红不褪色,酸性KMnO4溶液褪色,说明通入酸性高锰酸钾溶液的气体中不含二氧化硫而含有乙烯,所以能实现实验目的,故D不选;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质检验、探究化学反应速率影响因素、有机物基团之间的相互影响等知识点,明确实验原理、物质性质差异性是解本题关键,易错选项是B,题目难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
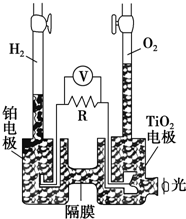 TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将光能转化为电能,同时也能将其转化为化学能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -10+3n | B. | -6+3n | C. | -(12-3n) | D. | -(4-2n) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于5 s | B. | 大于5 s | C. | 等于10 s | D. | 小于5 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,HAt极不稳定 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HIO4的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂与过量氧气反应,生成过氧化锂 | B. | 从锂到铯,密度由小到大 | ||
| C. | 从锂到铯,熔沸点依次升高 | D. | 钠与水反应不如钾与水反应剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| B. | 1L0.1 mol/L的NH4NO3溶液中氮原子数小于0.2NA | |
| C. | 某温度时,1LpH=6的纯水中含有1.0X10-6NA个OH- | |
| D. | 含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 816O、817O、818O互为同素异形体 | |
| B. | 正戊烷、异戊烷、新戊烷互为同系物 | |
| C. | O2与O3互为同位素 | |
| D. | CH3-CH2-OH与CH3-O-CH3互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com