
| A. | 2mol/LH2SO4溶液 | B. | 2mol/LNaOH溶液 | ||
| C. | 2mol/LMgSO4溶液 | D. | 硅酸溶胶(胶体粒子带负电荷) |
分析 Fe(OH)3胶体中加入电解质溶液发生聚沉生成Fe(OH)3沉淀,由Fe(OH)3的性质可知,选项中的物质只有盐酸溶液能溶解Fe(OH)3.
解答 解:A.胶体中加硫酸发生聚沉生成Fe(OH)3沉淀,Fe(OH)3会溶解在硫酸溶液中,故A正确;
B.胶体中加氢氧化钠溶液发生聚沉生成Fe(OH)3沉淀,Fe(OH)3不能溶解在氢氧化钠溶液中,故B错误;
C.胶体中加硫酸镁溶液发生聚沉生成Fe(OH)3沉淀,但Fe(OH)3不会溶解在硫酸镁溶液中,故C错误;
D.硅胶胶体带负电,胶体中加硅胶溶液发生聚沉生成Fe(OH)3沉淀,Fe(OH)3不会溶解在硅胶溶液中,故D错误.故选A.
点评 本题考查了胶体的性质及Fe(OH)3的性质,明确氢氧化铁不溶于水,但能溶解在强酸溶液中是解答本题的关键.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
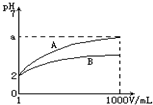 pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( )
pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( )| A. | A、B溶液浓度一定相等 | B. | 稀释后A溶液酸性比B溶液强 | ||
| C. | a=5时,A是强酸,B是弱酸 | D. | 若A、B都是弱酸,则2<a=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
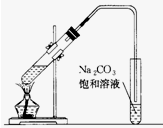 如图是实验室制乙酸乙酯的装置.在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合,然后轻轻地振荡试管,使之混合均匀.
如图是实验室制乙酸乙酯的装置.在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合,然后轻轻地振荡试管,使之混合均匀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L | B. | 0.017mol/L | C. | 0.02mol/L | D. | 0.05mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 碱 | 盐 | 氧化物 | |
| A | 硫 酸 | 纯 碱 | 硫酸钡 | 水 |
| B | 氢硫酸 | 烧 碱 | 纯 碱 | 石灰石 |
| C | 碳 酸 | 熟石灰 | 小苏打 | 二氧化硫 |
| D | 二氧化碳 | 苛性钾 | 食 盐 | 石灰石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化还原反应的实质是电子的得失 | |
| B. | 氧化还原反应中得、失电子的总数一定相等 | |
| C. | 有单质参加的反应一定是氧化还原反应 | |
| D. | 氧化还原反应中一定有氧原子的得到与失去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每个能级最多可容纳的电子数是2n2 | |
| B. | 在同一原子中没有运动状态完全相同的电子 | |
| C. | 同一能层中的不同能级的能量高低相同 | |
| D. | 不同能层中的s能级的能量高低相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
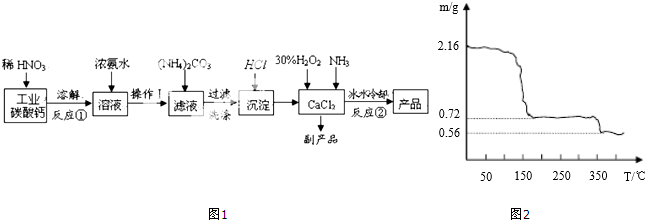
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com