
【题目】一定条件下,在体积恒定的密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-QkJ·mol-1,下列说法正确的是( )
2NH3(g) ΔH=-QkJ·mol-1,下列说法正确的是( )
A.达到平衡时反应放出的热量可能达到QkJ
B.升高温度,逆反应速率减小
C.当混合气体的密度不再发生变化时,说明反应达到平衡状态
D.达到平衡时,v正(N2)=3v逆(H2)
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下图中的A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色。请填空:
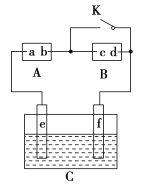
(1)电源A中a为________极。
(2)滤纸B上发生的总反应方程式为:______________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为:______________,电极f上发生的反应为:______________________,槽中盛放的电镀液可以是________或________(只要求填两种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.C3H8中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知图①一④的相关信息,下列相应叙述正确的是
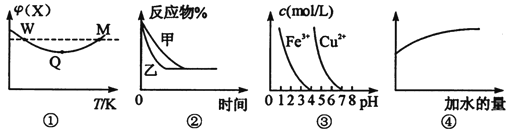
A.图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)![]() 3Z(g) △H<0,W点X的正反应速率等于M点X的正反应速率
3Z(g) △H<0,W点X的正反应速率等于M点X的正反应速率
B.图②表示压强对可逆反应A(g)+2B(g)![]() 3 C(g)+D(s)的影响,乙的压强比甲压强小
3 C(g)+D(s)的影响,乙的压强比甲压强小
C.据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
D.常温下,稀释0.1 mol·L-1Na2CO3溶液,图④中的纵坐标可以表示溶液中HCO3-的数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.Na2S的水解:S2-+ 2H2O![]() H2S + 2OH
H2S + 2OH
B.NaHCO3在水溶液中的电离:HCO3+ H2O![]() H2 CO3+ OH
H2 CO3+ OH
C.NH4Cl的水解:NH4+ + H2O![]() NH3·H2O + OH
NH3·H2O + OH
D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是
A. 4种溶液pH的大小顺序:①>④>③>②
B. 溶液①、②等体积混合后pH > 7,则c(NH4+) < c(NH3·H2O)
C. 向溶液①、②中分别加入25 mL 0.1mol/L盐酸后,溶液中c(NH4+):①>②
D. 向溶液③、④中分别加入12.5 mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)=Y(s)+2Z(g) ΔH>0,反应达到最大限度前,测得X的浓度与反应时间的数据如表所示:
反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
c(X)/mol·L-1 | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
试回答下列问题:
(1)0~3min内,用Z表示的平均反应速率v(Z)=___。
(2)分析该反应中反应物的浓度随时间的变化规律,得出的结论是___。由此结论推出a为___。
(3)该反应的逆反应速率随时间变化的关系如图所示,t2时改变了某一反应条件,则改变的条件为___。
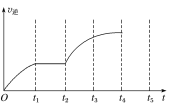
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测得某温度下0.5mol·L-1 HNO2(亚硝酸)溶液的pH约为2。
(1)写出HNO2的电离方程式___。
(2)将溶液加水稀释至10倍后,c(NO2-)___(填“增大”、“减小”或“不变”),n(H+)___(填“增大”、“减小”或“不变”),pH区间范围是___。
A.1~2 B.2~3 C.3~4 D.4~5
(3)分别取同浓度同体积的盐酸与亚硝酸,以同样的操作与足量NaOH溶液反应,测得反应溶液的最高温度盐酸要高于亚硝酸,说明可能的原因___。
(4)0.1mol·L-1 NaNO2溶液pH___7(填“>”、“<”或“=”),溶液中含有___种分子,溶液中c(Na+)___c(NO2-)(填“>”、“<”或“=”),下列措施能提高溶液中c(OH-)的是___。
A.适当升高温度 B.增加压强 C.加水 D.加入NH4Cl固体 E.加入Na2CO3固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com