
”¾ĢāÄæ”湤ŅµÉĻÉč¼Ę½«VOSO4ÖŠµÄK2SO4”¢SiO2ŌÓÖŹ³żČ„²¢»ŲŹÕµĆµ½V2O5µÄĮ÷³ĢČēĻĀ£ŗ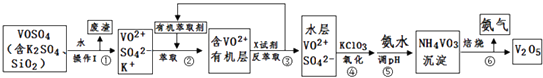
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©²½Öč¢ŁĖłµĆ·ĻŌüµÄ³É·ÖŹĒ£ØŠ“»ÆѧŹ½£©£¬²Ł×÷IµÄĆū³Ę £®
£Ø2£©²½Öč¢Ś”¢¢ŪµÄ±ä»Æ¹ż³Ģæɼņ»ÆĪŖ£ØĻĀŹ½R±ķŹ¾VO2+ £¬ HA±ķŹ¾ÓŠ»śŻĶČ”¼Į£©£ŗR2£ØSO4£©n £ØĖ®²ć£©+2nHA£ØÓŠ»ś²ć£©2RAn£ØÓŠ»ś²ć£©+nH2SO4 £ØĖ®²ć£©
¢ŚÖŠŻĶČ”Ź±±ŲŠė¼ÓČėŹŹĮæ¼ī£¬ĘäŌŅņŹĒ £®
¢ŪÖŠXŹŌ¼ĮĪŖ £®
£Ø3£©¢ŻµÄĄė×Ó·½³ĢŹ½ĪŖ £®
£Ø4£©25”ꏱ£¬Č”Ńł½ųŠŠŹŌŃé·ÖĪö£¬µĆµ½·°³ĮµķĀŹŗĶČÜŅŗpHÖ®¼ä¹ŲĻµČēĻĀ±ķ£ŗ
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
·°³ĮµķĀŹ% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
½įŗĻÉĻ±ķ£¬ŌŚŹµ¼ŹÉś²śÖŠ£¬¢ŻÖŠ¼ÓČė°±Ė®£¬µ÷½ŚČÜŅŗµÄ×ī¼ŃpHĪŖ£»Čō·°³ĮµķĀŹĪŖ93.1%Ź±²»²śÉśFe£ØOH£©3³Įµķ£¬ŌņČÜŅŗÖŠc£ØFe3+£©£¼ £®
£Ø5£©øĆ¹¤ŅÕĮ÷³ĢÖŠ£¬æÉŅŌŃ»·ĄūÓƵÄĪļÖŹÓŠŗĶ £®
”¾“š°ø”æ
£Ø1£©SiO2£»¹żĀĖ
£Ø2£©¼ÓČė¼īÖŠŗĶ²śÉśµÄĖį£¬Ę½ŗāÓŅŅĘĢįøßĮĖ·°µÄŻĶČ”ĀŹ£»ĮņĖį
£Ø3£©NH3H2O+VO3©ØTNH4VO3”ż+OH©
£Ø4£©1.7©1.8£»2.6”Į10©3mol/L
£Ø5£©ÓŠ»śŻĶČ”¼Į£»°±Ęų
”¾½āĪö”æ½ā£ŗ£Ø1£©·Ļ·°“߻ƼĮ£ØÖ÷ŅŖ³É·ÖV2O5”¢Fe2O3ŗĶSiO2µČ£©ĖįČÜŗó£¬V2O5”¢Fe2O3ŗĶĖį·“Ó¦£¬¶žŃõ»Æ¹č²»ÓėĖį·“Ó¦£¬¹żĀĖµĆµ½ĀĖŌüĪŖ¶žŃõ»Æ¹č£¬¹Ź“š°øĪŖ£ŗSiO2 £¬ ¹żĀĖ£»£Ø2£©¢ŚÖŠŻĶČ”Ź±±ŲŠė¼ÓČėŹŹĮæ¼ī£¬·ÖĪöĘ½ŗā£¬Rn+£ØĖ®²ć£©+nHA£ØÓŠ»ś²ć£©RAn£ØÓŠ»ś²ć£©+nH+£ØĖ®²ć£©£¬¼ÓČėµÄ¼ī»įŗĶĘ½ŗāÖŠµÄĒāĄė×Ó·“Ó¦“Ł½ųĘ½ŗāÕżĻņ½ųŠŠ£»¢ŪÖŠ·“ŻĶČ”Ź±¼ÓČėµÄXŹŌ¼ĮŹĒŅÖÖĘĘ½ŗāÕżĻņ½ųŠŠ£¬æÉŅŌ¼ÓČėĮņĖįŅÖÖĘĘ½ŗāÕżĻņ½ųŠŠ£¬
¹Ź“š°øĪŖ£ŗ¼ÓČė¼īÖŠŗĶ²śÉśµÄĖį£¬Ę½ŗāÓŅŅĘĢįøßĮĖ·°µÄŻĶČ”ĀŹ£»ĮņĖį£»£Ø3£©°±Ė®ÓėVO3©·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗNH3H2O+VO3©ØTNH4VO3”ż+OH© £¬ ¹Ź“š°øĪŖ£ŗNH3H2O+VO3©ØTNH4VO3”ż+OH©£»£Ø4£©øł¾Ż±ķÖŠŹż¾ŻÅŠ¶Ļ£¬¢ŻÖŠ¼ÓČė°±Ė®£¬µ÷½ŚČÜŅŗpH×ī¼ŃÖµĪŖ1.7©1.8£¬“ĖŹ±±µ³ĮµķĀŹ“ļµ½×ī“󣬊čŅŖ°±Ė®Įæ½ĻŠ”£»Čō·°³ĮµķĀŹĪŖ93.1%Ź±²»²śÉśFe£ØOH£©3³Įµķ£¬“ĖŹ±PH=2£¬c£ØH+£©=10©2mol/L£¬c£ØOH©£©=10©12mol/L£¬ŌņČÜŅŗÖŠc£ØFe3+£©ÅضČŅĄ¾ŻČܶȻż¼ĘĖć£¬Ksp[Fe£ØOH£©3]=c£ØFe3+£©”Įc3£ØOH©£©=2.6”Į10©39 £¬ ¼ĘĖćµĆµ½c£ØFe3+£©=2.6”Į10©3molL©1 £¬ ²»²śÉśFe£ØOH£©3³Įµķ£¬ŌņČÜŅŗÖŠc£ØFe3+£©£¼2.6”Į10©3molL©1 £¬
¹Ź“š°øĪŖ£ŗ1.7©1.8£»2.6”Į10©3£»£Ø5£©·ÖĪöĮ÷³ĢĶ¼£¬ĪļÖŹ²Ī¼Ó·“Ó¦£¬·“Ó¦¹ż³ĢÖŠÓÖÉś³ÉµÄĪļÖŹ£¬»ņÖŲø“ĄūÓƵÄĪļÖŹæÉŅŌŃ»·ĄūÓĆ£¬Į÷³ĢÖŠÓŠ»śŻĶČ”¼Į”¢°±ĘųæÉŅŌŃ»·ĄūÓĆ£¬¹Ź“š°øĪŖ£ŗÓŠ»śŻĶČ”¼Į£»°±Ęų£®
£Ø1£©·Ļ·°“߻ƼĮ£ØÖ÷ŅŖ³É·ÖV2O5”¢Fe2O3ŗĶSiO2µČ£©ĖįČÜŗ󣬶žŃõ»Æ¹č²»ÓėĖį·“Ó¦£¬¹żĀĖµĆµ½ĀĖŌüĪŖ¶žŃõ»Æ¹č£»£Ø2£©¢ŚÖŠŻĶČ”Ź±±ŲŠė¼ÓČėŹŹĮæ¼ī£¬»įŗĶĘ½ŗāÖŠµÄĒāĄė×Ó·“Ó¦“Ł½ųĘ½ŗāÕżĻņ½ųŠŠ£»¢ŪÖŠ·“ŻĶČ”Ź±¼ÓČėµÄXŹŌ¼ĮŹĒŅÖÖĘĘ½ŗāÕżĻņ½ųŠŠ£»£Ø3£©ŅĄ¾Ż°±Ė®ÓėVO3©·“Ó¦ÅäĘ½µĆµ½Ąė×Ó·½³ĢŹ½£»£Ø4£©øł¾Ż±ķÖŠŹż¾ŻÅŠ¶Ļ£¬¢ŻÖŠ¼ÓČė°±Ė®£¬µ÷½ŚČÜŅŗpH×ī¼ŃÖµĪŖ1.8£¬“ĖŹ±±µ³ĮµķĀŹ“ļµ½×ī“󣬊čŅŖ°±Ė®Įæ½ĻŠ”£»ŅĄ¾Ż³ĮµķČܶȻż¼ĘĖć·ÖĪö£»£Ø5£©·ÖĪöĮ÷³ĢĶ¼£¬ĪļÖŹ²Ī¼Ó·“Ó¦£¬·“Ó¦¹ż³ĢÖŠÓÖÉś³ÉæÉŅŌŃ»·ĄūÓĆ£»



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³ŃŠ¾æŠŌѧĻ°Š”×éĶ¬Ń§²éŌÄ׏ĮĻµĆÖŖ£¬ĘÆ°×·ŪÓėĮņĖįČÜŅŗ·“Ó¦æÉÖĘČ”ĀČĘų£¬»Æѧ·½³ĢŹ½ĪŖCa£ØClO£©2+CaCl2+2H2SO4 ![]() 2CaSO4+2Cl2”ü+2H2O£¬ĖūĆĒÉč¼ĘĮĖČēĶ¼1ĖłŹ¾µÄÖĘČ”ĀČĘų²¢ŃéÖ¤ĘäŠŌÖŹµÄŹµŃé×°ÖĆ£ŗ
2CaSO4+2Cl2”ü+2H2O£¬ĖūĆĒÉč¼ĘĮĖČēĶ¼1ĖłŹ¾µÄÖĘČ”ĀČĘų²¢ŃéÖ¤ĘäŠŌÖŹµÄŹµŃé×°ÖĆ£ŗ 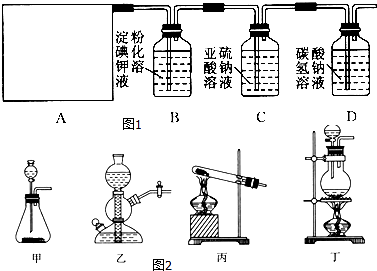
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©øĆŹµŃéÖŠA²æ·ÖµÄ×°ÖĆŹĒĶ¼2ÖŠµÄ £®
£Ø2£©AÖŠ·¢Éś·“Ó¦Ņ»¶ĪŹ±¼äŗó£¬BÖŠµÄĻÖĻóŹĒ £® BÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £®
ÕūĢ׏µŃé×°ÖĆ“ęŌŚµÄĆ÷ĻŌȱĻŻŹĒ £®
£Ø3£©Š“³öD×°ÖĆÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ £®
£Ø4£©ĒėÄć°ļøĆŠ”×éĶ¬Ń§Éč¼ĘŅ»øöŹµŃ飬֤Ć÷Ļ“ĘųĘæCÖŠµÄNa2SO3Ņѱ»Ńõ»ÆĪŖNa2SO4£Ø¼ņŹöŹµŃé²½Öč£©£ŗ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ[»Æѧ”Ŗ”ŖŃ”ŠŽ5£ŗÓŠ»ś»Æѧ»ł“”]
ŅŌ·¼ĻćĢžAĪŖŌĮĻŗĻ³ÉÓŠ»śĪļFŗĶIµÄŗĻ³ÉĀ·ĻßČēĻĀ£ŗ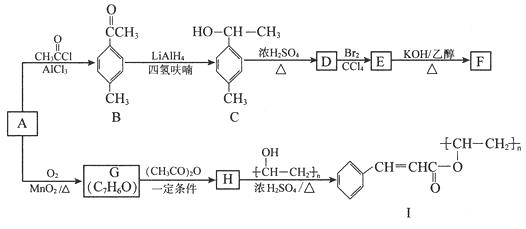
£Ø1£©AµÄ·Ö×ÓŹ½ĪŖ £¬ CÖŠ¹ŁÄÜĶÅĆū³ĘĪŖ”£
£Ø2£©D·Ö×ÓÖŠ×ī¶ąÓŠøöŌ×Ó¹²Ę½Ćę”£
£Ø3£©EÉś³ÉFµÄ·“Ó¦ĄąŠĶĪŖ £¬ GµÄ½į¹¹¼ņŹ½ĪŖ”£
£Ø4£©ÓÉHÉś³ÉIµÄ»Æѧ·½³ĢŹ½ĪŖ”£
£Ø5£©·ūŗĻĻĀĮŠĢõ¼žµÄBµÄĶ¬·ÖŅģ¹¹ĢåÓŠÖÖ(²»æ¼ĀĒĮ¢ĢåŅģ¹¹)£¬ĘäÖŠŗĖ“Ź²ÕńĒāĘ×ĪŖ4×é·åĒŅĆ껿±ČĪŖ6”Ć2”Ć1”Ć1µÄŹĒ
(Š“³öĘäÖŠŅ»ÖֵĽį¹¹¼ņŹ½)”£
¢ŁŹōÓŚ·¼Ļć»ÆŗĻĪļ ¢ŚÄÜ·¢ÉśŅų¾µ·“Ó¦
£Ø6£©ŅŃÖŖRCOOH ![]() RCOCl£¬²ĪÕÕÉĻŹöŗĻ³ÉĀ·Ļߣ¬ŅŌ±½ŗĶ±ūĖįĪŖŌĮĻ(ĪŽ»śŹŌ¼ĮČĪŃ”)£¬Éč¼ĘÖʱø
RCOCl£¬²ĪÕÕÉĻŹöŗĻ³ÉĀ·Ļߣ¬ŅŌ±½ŗĶ±ūĖįĪŖŌĮĻ(ĪŽ»śŹŌ¼ĮČĪŃ”)£¬Éč¼ĘÖʱø ![]() µÄŗĻ³ÉĀ·Ļß”£
µÄŗĻ³ÉĀ·Ļß”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŹµŃéŹŅĄūÓĆÅØŃĪĖįŗĶMnO2ÖĘĀČĘų£¬Öʱø×°ÖĆÖŠÓ¦°²×°·ÖŅŗĀ©¶·¶ų²»ÄÜŹ¹ÓĆ³¤¾±Ā©¶·£¬ÓŠ¹ŲĄķÓÉŠšŹö“ķĪóµÄŹĒ()
A.·ĄÖ¹ĀČĘųĄ©É¢µ½æÕĘųÖŠŌģ³ÉĪŪČ¾
B.±ćÓŚæŲÖĘ¼ÓČėŃĪĖįµÄĮæ
C.³¤¾±Ā©¶·²»±ćÓŚĢķ¼ÓŅŗĢå
D.¾”Įæ±ÜĆāHCl»Ó·¢µ½æÕĘųÖŠ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĶ¼ŹĒĪŽ»śĪļA”«M ŌŚŅ»¶ØĢõ¼žĻĀµÄ×Ŗ»Æ¹ŲĻµ(²æ·Ö²śĪļ¼°·“Ó¦Ģõ¼žĄ“ĮŠ³ö)”£ĘäÖŠ£¬IŹĒÓɵŲæĒÖŠŗ¬Įæ×ī¶ąµÄ½šŹōŌŖĖŲ×é³ÉµÄµ„ÖŹ£¬KŹĒŅ»ÖÖŗģ×ŲÉ«ĘųĢ壬 C ŹĒŅ»ÖÖĒæĖį”£

ĒėĢīŠ“ĻĀĮŠæÕ°×£ŗ
(1)Š“³öĻĀĮŠĪļÖŹµÄ»ÆѧŹ½£ŗA£ŗ___________ E£ŗ_____________”£
(2)Š“³ö·“Ó¦¢ÜµÄĄė×Ó·½³ĢŹ½£ŗ______________________”£
Š“³ö·“Ó¦¢ßµÄ»Æѧ·½³ĢŹ½£ŗ______________________”£
Š“³ö·“Ó¦¢āµÄ»Æѧ·½³ĢŹ½£ŗ______________________”£
(3)ŌŚ·“Ó¦¢Ś”¢¢Ū”¢¢Ž”¢¢ą”¢¢įÖŠ£¬¼ČŹōÓŚ»ÆŗĻ·“Ó¦ÓÖŹōÓŚŃõ»Æ»¹Ō·“Ó¦µÄ__________________(ĢīŠ“ŠņŗÅ) ”£
(4)Š“³ö¼ģŃéMČÜŅŗÖŠŃōĄė×ӵķ½·Ø£ŗ______________________”£
(5)½«»ÆŗĻĪļDÓėKNO3”¢KOHøßĪĀ¹²ČŚ£¬æÉÖʵĆŅ»ÖÖ”°ĀĢÉ«”±»·±£øߊ§¾»Ė®¼ĮK2FeO4 (øßĢśĖį¼Ų)£¬Ķ¬Ź±»¹Éś³ÉKNO2ŗĶH2O”£Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½²¢ÓĆĖ«ĻßĒűź³öµē×Ó×ŖŅĘ·½ĻņŗĶŹżÄæ£ŗ___________”£
(6)ClO2Ņ²ŹĒĀĢÉ«¾»Ė®¼Į£¬ClO2Öʱø·½·Ø½Ļ¶ą£¬ĪŅ¹śæĘѧ¼ŅĢ½Ė÷µÄŠĀ·½·ØŹĒ£ŗĀČĘų(Cl2)ŗĶ¹ĢĢåŃĒĀČĖįÄĘ(NaClO2)·“Ó¦£¬Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ__________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·“Ó¦ÖŠ£¬²»ÄÜĢåĻÖĖįµÄĶØŠŌµÄ·“Ó¦ŹĒ
A. Fe+H2SO4=FeSO4+H2ӟ
B. AgNO3+HCl=AgCl”ż+HNO3
C. CaO+2HNO3=Ca(NO3)2+H2O
D. C + 2H2SO4£ØÅØ£©![]() CO2”ü+2SO2”ü+2H2O
CO2ӟ+2SO2ӟ+2H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éĄė×ÓŌŚÖø¶ØµÄČÜŅŗÖŠ£¬ÄÜ“óĮæ¹²“ęµÄŹĒ£Ø £© ¢ŁĖįŠŌČÜŅŗÖŠ£ŗFe2+”¢Al3+”¢NO ![]() ”¢Cl©”¢I©
”¢Cl©”¢I©
¢ŚpH=13µÄČÜŅŗ£ŗNa+”¢CO ![]() ”¢SO
ӢSO ![]() ӢAlO
”¢AlO ![]() ”¢S2©
”¢S2©
¢ŪĖ®µēĄė³öĄ“µÄc£ØH+£©=10©13mol/LµÄČÜŅŗ£ŗNH4+”¢K+”¢NO ![]() ”¢S2O
ӢS2O ![]()
¢Ü¼ÓČėĀĮʬÄܷųöH2µÄČÜŅŗ£ŗNa+”¢HCO ![]() ”¢Cu2+”¢SO
ӢCu2+ӢSO ![]()
¢ŻµĪ¼ÓŹÆČļŹŌŅŗĻŌŗģÉ«µÄČÜŅŗ£ŗFe3+”¢NH ![]() ”¢Cl©”¢NO
”¢Cl©”¢NO ![]() £®
£®
A.¢Ł¢Ś
B.¢Ś¢Ū
C.¢Ś¢Ü¢Ż
D.¢Ś¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éĄė×ÓŌŚ³£ĪĀĻĀŅ»¶ØÄÜ“óĮæ¹²“ęµÄŹĒ£Ø £©
A.pH=0µÄĪŽÉ«ČÜŅŗÖŠ£ŗCl©”¢Na+”¢SO ![]() ”¢Fe2+
ӢFe2+
B.ŌŚ ![]() ?=1012µÄČÜŅŗÖŠ£ŗNH
?=1012µÄČÜŅŗÖŠ£ŗNH ![]() ”¢NO
”¢NO ![]() ”¢K+”¢Cl©
”¢K+”¢Cl©
C.¼ÓČėĀĮ·ŪÄܷųöH2µÄČÜŅŗÖŠ£ŗMg2+”¢NH ![]() ”¢NO
”¢NO ![]() ”¢Cl©
”¢Cl©
D.ŗ¬ÓŠ“óĮæFe3+µÄČÜŅŗÖŠ£ŗAl3+”¢SCN©”¢Br©”¢Na+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»ĆܱÕČŻĘ÷ÖŠ£¬ÓƵČĪļÖŹµÄĮæµÄAŗĶB·¢ÉśČēĻĀ·“Ó¦£ŗA£Øg£©+2B£Øg£©2C£Øg£©£¬·“Ó¦“ļĘ½ŗāŹ±£¬Čō»ģŗĻĘųĢåÖŠAŗĶBµÄĪļÖŹµÄĮæÖ®ŗĶÓėCµÄĪļÖŹµÄĮæĻąµČ£¬ŌņÕāŹ±AµÄ×Ŗ»ÆĀŹĪŖ£Ø £©
A.40%
B.50%
C.60%
D.70%
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com