(2010?扬州模拟)工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高.
(1)基态钛原子的核外电子排布式为
[Ar]3d24s2
[Ar]3d24s2
.
(2)TiCl
4在常温下是一种无色液体,而FeCl
3可用升华法提纯,则两种氯化物均属于
分子
分子
晶体.
(3)SO
42-和 S
2O
82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.下列说法正确的是
B
B
.
A.SO
42-中存在σ键和π键且与PO
43-离子互为等电子体
B.S
2O
82-中存在非极性键且有强氧化性
C.S
2O
82-比SO
42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是
MgO
MgO
,原因是
均为离子晶体,而Mg2+与O2-半径和小于K+与Cl-半径和且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高
均为离子晶体,而Mg2+与O2-半径和小于K+与Cl-半径和且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高
.
(5)硫与氯可形成化合物SCl
2,则该分子中硫原子的杂化方式为
sp3
sp3
,分子的空间构型为
V形(折线形)
V形(折线形)
.
(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为
2:3
2:3
.


 ,其结构式为
,其结构式为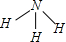 ,故A正确;
,故A正确;  ,故C正确;
,故C正确;

 阅读快车系列答案
阅读快车系列答案