
| A、温度下降10℃,两倍溶液的pH均不变 |
| B、分别加水稀释10倍,两溶液的pH仍相等 |
| C、用同溶液的盐酸中和,消耗的盐酸体积相同 |
| D、加入适量的氯化铵晶体,两溶液的pH均减小 |


科目:高中化学 来源: 题型:
| A、该反应中铁元素被氧化,硫元素被还原 |
| B、该反应中每消耗3molFe2+,3molFe2+失去3mol电子 |
| C、该反应中转移电子总数为4e- |
| D、Fe2+、S2O32-在碱性条件下能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
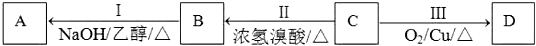
查看答案和解析>>
科目:高中化学 来源: 题型:
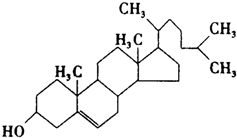
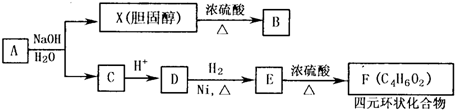
查看答案和解析>>
科目:高中化学 来源: 题型:
| 175℃ |
| △ |
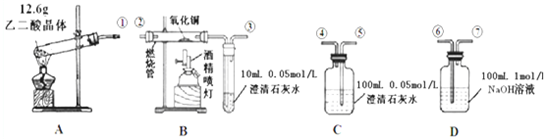
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 Fenton法常用于处理含难降解有机物的工业废水,通常先调节好Fe2+等离子的浓度,再向废水中加入H2O2,所产生的羟基自由基(Fe2++H2O2→Fe3++OH-+HO?)能氧化降解污染物.如:降解废水中丙二醇(分子式C3H8O2)的反应为:C3H8O2+8H2O2
Fenton法常用于处理含难降解有机物的工业废水,通常先调节好Fe2+等离子的浓度,再向废水中加入H2O2,所产生的羟基自由基(Fe2++H2O2→Fe3++OH-+HO?)能氧化降解污染物.如:降解废水中丙二醇(分子式C3H8O2)的反应为:C3H8O2+8H2O2| FeSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com